Kardiyojenik Şok
Holger Thiele, M.D., and Christian Hassager, M.D. N Engl J Med 2026;394:62-77. DOI: 10.1056/NEJMra2312086
Özet
Kardiyojenik şok, yeni tanımlanan evreleme ve bu heterojen bozukluğun ayrıntılı fenotiplenmesi gibi yeni uygulamalara rağmen hâlâ büyük ölçüde çözülememiş bir sorun olmaya devam etmektedir. Mortaliteyi azaltmaya yönelik kanıta dayalı stratejiler oldukça sınırlıdır ve kardiyojenik şokun başlangıcından sonraki 30 gün içinde mortalite oranı %40–50 düzeyinde kalmaktadır. Kanıta dayalı stratejiler, miyokart enfarktüsüne bağlı kardiyojenik şokta suçlu lezyonun revaskülarizasyonunu ve ST-segment elevasyonlu miyokart enfarktüsü olan seçilmiş hastalarda mikroaksiyel akım pompası kullanımını içermektedir. Bu yazıda kardiyojenik şokun yönetimi ve tanısına ilişkin son gelişmeleri evreleme ve tedaviler dâhil olmak üzere özetliyor ve daha fazla araştırma gerektiren alanları tanımlıyoruz.
Tanım ve Tanı
Shock Academic Research Consortium, kardiyojenik şoku, kalıcı doku hipoperfüzyonuna ilişkin klinik ve biyokimyasal kanıtlarla sonuçlanan kardiyak bir bozukluk olarak tanımlamıştır.¹ Bu tanımın temel unsurları arasında, 30 dakikadan uzun süre sistolik kan basıncının 90 mmHg’nin altında olması ya da 90 mmHg veya daha yüksek bir kan basıncını sürdürmek için inotrop, vazopressör veya mekanik dolaşım desteği gereksinimi ile birlikte sistemik hipoperfüzyon bulgularının varlığı yer almaktadır. Kardiyojenik şokun ayrıca normotansif kardiyojenik şok gibi alt tipleri de vardır; bu tabloda sistolik kan basıncı 90 mmHg’nin üzerinde olmasına rağmen organ hipoperfüzyonu kanıtı mevcuttur. ¹ Septik şok ve hipovolemik şok da hipotansiyon ve son-organ hipoperfüzyonu ile seyreder, bunlar eş zamanlı kardiyojenik şokla birlikte ortaya çıkabilir, karışık şok (mixed shock) ismini alır.² Klinik uygulamada kardiyojenik şok tanısı; sıvı replasmanına yeterli yanıt alınamayan ısrarcı hipotansiyon, soğuk yetersiz perfüze ekstremiteler, oligüri veya mental durum değişikliği gibi son-organ hipoperfüzyonu bulguları ile konulur. Yerleşik kardiyojenik şokta, arteriyel laktat düzeyinin yüksek olması, yetersiz doku perfüzyonunun biyokimyasal bir belirtecidir. ¹˒³ Tanı aynı zamanda kardiyak disfonksiyon gösteren bir ekokardiyogram gerektirir. Sağ kalp kateterizasyonu ile ölçülen ayırıcı hemodinamik özellikler de kardiyojenik şoku tanımlamak için kullanılır, bunlara genellikle yüksek sistemik vasküler direnç indeksiyle (>2200 dyn·sn/cm⁵) birlikte görülen düşük kardiyak indeks (≤2,2 L/dk/m² vücut yüzey alanı) şeklindedir.¹˒² Bu hemodinamik özellikler, diğer şok tiplerinin veya karışık şok tablolarının ayırıcı tanısında da yardımcıdır. Kardiyojenik şokun büyük randomize çalışmalarda kullanılan tanımları, çoğu zaman klinik tanımdan farklılık göstermektedir ve Tablo 1’de sunulmuştur.
Tablo 1 Randomize Çalışmalarda Kardiyojenik Şok Tanımları*
|
SHOCK5 |
TRIUMPH6 |
IABP-SHOCK II7 |
CULPRIT-SHOCK8 |
ECLS-SHOCK4 |
DanGer Shock9 |
|
Aşağıdakilerden biri: Artı, aşağıdaki her ikisi: Hemodinamik ölçütler†: |
Miyokart enfarktüsü (AMI) — infarktla ilişkili arterin açıklığının kendiliğinden ya da PKG (PCI) sonrasında sağlanmış olması. PKG’den sonra ≥1 saat boyunca devam eden refrakter kardiyojenik şok,
Son-organ hipoperfüzyonu Sol ventrikül dolum basıncında artışı gösteren klinik veya hemodinamik ölçütlerin bulunması Sol ventrikül ejeksiyon fraksiyonu (LVEF) < %40
|
Aşağıdakilerden biri: Artı: Artı, aşağıdakilerden en az birinin varlığı ile birlikte son-organ perf. bozulma:
|
PKG (PCI) ile erken revask. planlanan miyokart enfarktüsü (MI) Çok damar hastalığı: En az iki majör damarda (çap ≥2 mm) %70’ten fazla darlık bulunması ve suçlu lezyonun tanımlanmış olması Aşağıdakilerden biri: Pulmoner konjesyon Artı, aşağıdakilerden en az biri ile birlikte organ perf. bozulma:
|
PKG (PCI) veya KABG ile erken revask. planlanan miyokart enfarktüsü (MI) Aşağıdakilerden biri: Artı, aşağıdakilerden en az biri ile birlikte organ perf. bozulma:
|
Randomizasyondan önce <36 saat içinde gelişen STEMI Aşağıdaki bulgularla birlikte kardiyojenik şok:
|
* AMI, akut miyokart enfarktüsünü; CABG, koroner arter baypas greftlemesini; LVEF, sol ventrikül ejeksiyon fraksiyonunu; MI, miyokart enfarktüsünü; PCI, perkütan koroner girişimi;Perf, perfüzyon; Revask, revaskülerizasyon; SBP, sistolik kan basıncını; STEMI, ST-segment elevasyonlu miyokart enfarktüsünü; SvO₂ ise karışık venöz oksijen satürasyonunu ifade eder. † Hemodinamik ölçütler, anterior enfarktüs varlığında veya akciğer grafisinde pulmoner konjesyon gösterilmişse gerekli değildir.
Kardiyovasküler Anjiyografi ve Girişimler Derneği ile Amerikan Kalp Yetersizliği Derneği, kardiyojenik şok için klinik ciddiyete dayalı bir evreleme sistemi önermiştir. ³ Bu sistemde kardiyojenik şok beş kategoriye ayrılmaktadır: Risk altında (evre A), Şok öncesi / başlangıç (evre B), Klasik şok (evre C), Kötüleşen şok (evre D), Aşırı/ileri şok (evre E)

Bu sistemde kullanılan evreler; kan basıncı, biyobelirteçler (laktat, alanin aminotransferaz düzeyi ve pH) ve tedavi yoğunluğu ile tanımlanmakta olup, günümüzde araştırmalarda ve klinik uygulamada yaygın olarak kullanılmaktadır. ⁴˒⁹–¹¹
Ancak bu derecelendirme sisteminin sınırlılıkları arasında, kardiyojenik şokun dinamik doğası nedeniyle en az iki klinik değerlendirme gerektirmesi yer almaktadır. Ayrıca şok evresinin belirlenmesinde belli bir düzeyde sübjektif yorum bulunması, çalışmalar arasında karşılaştırma yapılmasını güçleştirmektedir. ¹¹
Patofizyolojik Faktörler
Kardiyojenik şok, kalp fonksiyonunda ve kardiyak indekste belirgin azalmalar ile karakterizedir. Bu değişiklikler, düşük kan basıncı ve koroner iskemi, bunu takiben azalmış kardiyak kontraktilite ve kardiyak indekste daha ileri düşüş ile seyreden zararlı bir aşağı yönlü döngüyü tetikler. Şokun erken döneminde kompansatuvar sistemik vazokonstriksiyon görülebilir; ancak şokun daha ileri evrelerinde bu durum, inflamatuvar reaksiyonlara bağlı patolojik vazodilatasyon ile karşıt yönde etkilenebilir. ² Kardiyak indeksteki azalma, arteriyel laktat düzeylerini artıran şiddetli doku hipoksemisine yol açar. Kardiyojenik şok, kalbin kendisi de dahil olmak üzere böbrek, karaciğer, akciğer, gastrointestinal sistem, immün sistem ve koagülasyon sistemi gibi organlarda çoklu organ yetmezliğine yol açabilir. Bu nedenle, laktat düzeylerine ek olarak, inflamasyonu ve organ disfonksiyonunu gösteren biyobelirteç düzeyleri de kötü prognoz ile ilişkilidir (Şekil 1).
Şekil 1-B Kardiyojenik şokta çoklu organ tutulumu ve buna eşlik eden klinik bulgular ile laboratuvar belirteçleri
Inflamasyon
• Sistemik inflamatuar yanıt sendromu (SIRS)
• Interleukin(IL)-6, IL-1, IL-8
• Dipeptidyl peptidase 3,
• Interferon-γ ,tumor necrosis factor α.
Sonuç; CRP artışı
Pulmoner zedelenme
• Konjesyon
• Muhtemel ventilasyon injury (zedelenme)
• Muhtemel pneumoni
Sonuç; Oksijen saturasyonunda düşme
Karaciğer zedelenmesi
•Hipoksik hepatit
• Akut karaciğer yetmezliği
• Karaciğer hücre nekrozu
Sonuç; AST, ALT ve billürubin düzeylerinde artış
Mikrovasküler zedelenme
• Endotelde şişme (ödem)
• Vazokonstriksüyon
• Staz ve akıntı
• Mikrotrombus
• Lökosit adezyonu
Sonuç; Laktat artışı
Barsak zedelenmesi
• Bütünlüğün bozulması
• Bakterilerin duvarı geçerek sistemik etkisi
• Barsak nekrozu
Sonuç; Laktat artışı, enfeksiyon
Serebral
• Hipoperfüzyon- konfüzyon
Kardiyak zedelenme
• Miyokardiyal iskemi
• Pompa fonksiyonunda daha fazla azalma
Sonuç; BNP ve kardiyak troponin yükselmesi
Adale zedelenmesi
•Perfüzyon azalması
• Katabolizma
• Proteolizis
• Adale yıkımı
Böbrek zedelenmesi
• Hipoperfüzyon – Oliguri
• Tubular nekroz – Anuria
Sonuç; Kreatinin ve sistatin C yükselmesi
Cilt
• Soğuk ve nemli– Kapiller doluş zamanının azalmasın bağlı
Etiyolojik ve Epidemiyolojik Faktörler ve Kardiyojenik Şok Fenotipleri
Kardiyojenik şokun nedenleri, etiyolojik faktörlere göre şu gruplara ayrılabilir:
akut miyokard enfarktüsü; miyokard enfarktüsü ile ilişkili olmayan faktörler (örneğin yeni gelişmiş veya akut-kronik kalp yetersizliği); ya da ikincil non-miyokardiyal nedenler ve kardiyotomi sonrası şok (Şekil 2).¹
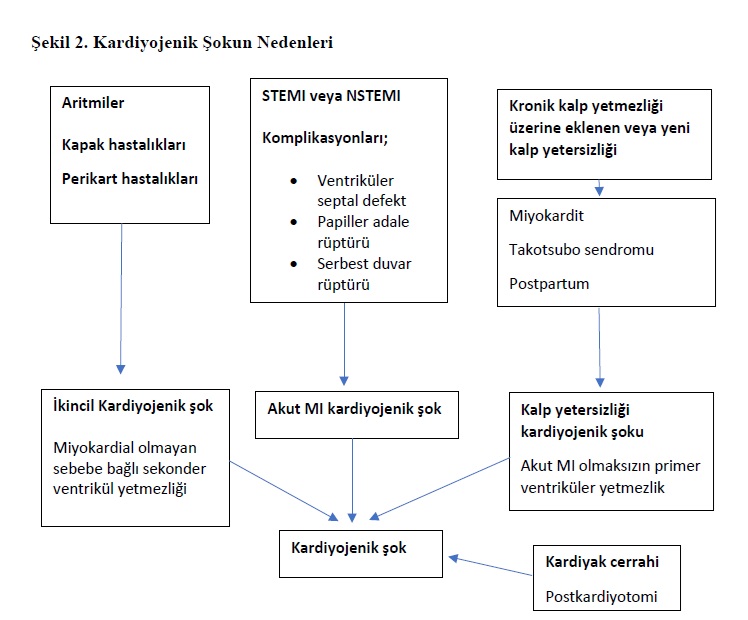
On yıllar boyunca, akut miyokard enfarktüsü sonrası gelişen ventrikül yetmezliği kardiyojenik şokun en sık nedeni olmuş, enfarktüse bağlı mekanik komplikasyonlar ise daha nadir bir neden olarak görülmüştür. Ancak akut miyokard enfarktüsü tedavi stratejileri; daha iyi korunma ve erken revaskülarizasyon sayesinde ilerledikçe, miyokard enfarktüsüne atfedilen kardiyojenik şok olaylarının göreli oranı giderek azalmış ve günümüzde enfarktüsle ilişkili olmayan kardiyojenik şok, enfarktüs ilişkili kardiyojenik şoku sayıca geçmiştir (Şekil 3).¹²
Şekil 3 Medikal ve mekanik solunum desteği
Kardiyojenik şokta mortalite yüksek kalmaya devam etmektedir. Enfarktüsle ilişkili kardiyojenik şoklu hastalarda yapılan erken dönem bir revaskülarizasyon çalışmasında mortalite %47 olarak bildirilmiştir.⁵ Günümüzde de kardiyojenik şok, miyokard enfarktüsü nedeniyle hastaneye yatırılan hastalarda en önde gelen ölüm nedenidir.¹³ Bazı kayıt çalışmalarında mortalitede artış bildirilmiştir; bu durum yaşlanan nüfus, eşlik eden hastalıkların artışı ve kardiyojenik şoklu hastalarda olumsuz risk profillerinin daha sık görülmesi ile açıklanabilir.¹⁴,¹⁵ Buna ek olarak, enfarktüsle ilişkili kardiyojenik şoklu hastaların %71’inde kırılganlık (frailty) sorunları bulunmaktadır.¹⁶
Kardiyojenik şoklu 8974 hasta arasında, hastane içi mortalite; karma nedenli kardiyojenik şokta %48, enfarktüsle ilişkili kardiyojenik şokta %41, yeni gelişmiş kalp yetersizliğinde %31, ikincil nedenlere bağlı kardiyojenik şokta %31 ve akut-kronik kalp yetersizliğine bağlı kardiyojenik şokta %25 olarak saptanmıştır.¹² Kardiyojenik şoklu hastalarda ölüm nedenlerini değerlendirmek çoğu zaman güçtür; bunun nedeni çoklu organ disfonksiyonu ya da yaşam destek tedavisinin sonlandırılmasıdır. Yakın tarihli bir kayıt analizi, en baskın ölüm nedeninin persistan kardiyojenik şok olduğunu; bunu aritmi, anoksik beyin hasarı ve solunum yetmezliğinin izlediğini göstermiştir.¹⁷ Kardiyojenik şokun fenotiplendirilmesi, ventrikül yetmezliğinin tipine göre yapılabilir; en baskın form sol ventrikül yetmezliğidir.¹⁸ Bununla birlikte biventriküler yetmezlik de sıktır ve sağ ventrikül tutulumu, enfarktüsle ilişkili kardiyojenik şoklu hastaların %44’ünde gözlenmiş olup enfarktüsle ilişkili olmayan kardiyojenik şokta daha da sık görülmektedir.¹⁸ Diğer fenotipler, mekanik komplikasyonlarla ilişkilidir; örneğin enfarktüsle ilişkili kardiyojenik şokta akut ventrikül rüptürü veya akut mitral yetersizliği gibi.¹⁹,²⁰ Bu fenotipler; sıvı yönetimi, inotrop ve vazopressör kullanımı, cerrahi ve diğer girişimler ile mekanik dolaşım destek cihazlarının seçimi açısından özgün tedavi stratejileri gerektirir.²¹,²²
Bir başka şok fenotipi, kardiyak arrest sonrası resüsitasyon uygulanmış ve komada olan hastalarda görülür. Bu hastalarda spontan dolaşım geri döndükten sonra kardiyak sersemlik (cardiac stunning) nedeniyle kalp fonksiyonları azalmış olabilir. Bu hastaların birçoğu entübe edilmiş ve sedatize edilmiştir; bu da uygulanan girişimlerin vazodilatör ve kardiyodepresan etkilerini dengelemek amacıyla vazopressör kullanımını gerektirir. Aynı zamanda, uzun süreli “akımsız” (no-flow) veya “düşük akımlı” (slow-flow) dönemlere bağlı olarak laktat düzeyleri yüksektir; kardiyak arrest sonrası komadaki hastalarda başlangıç laktat düzeyleri kardiyak indeks ile iyi korelasyon göstermez.²³ Buna ek olarak, resüsitasyon sonrası komada olan hastaların yaklaşık %20–30’u dolaşım yetmezliğinden ziyade beyin hasarı nedeniyle kaybedilebilir.⁴,²⁴
Prognozun Değerlendirilmesi
Preşok,²⁵–²⁷ şok,²⁸,²⁹ ve mekanik dolaşım desteği altındaki şok evrelerindeki¹³ hastalar için kullanılan çok sayıda skorlama sistemi aracılığıyla prognozu değerlendirmek üzere çeşitli klinik faktörler ve biyobelirteçler kullanılmıştır (bu makalenin tam metniyle birlikte NEJM.org’da bulunan Ekler bölümündeki Tablo S1). Klinik pratikte, Kardiyovasküler Anjiyografi ve Girişimler Derneği’nin (Society for Cardiovascular Angiography and Interventions) şok evreleme sistemi kullanılmalıdır (Şekil 1); bu sistem her evrede mortalitenin belirlenmesi açısından yararlıdır, ancak bireysel prognozu öngörmede kesin değildir.³
Tedavi
Bakım Sistemleri
Kardiyojenik şoklu hastalar; mekanik dolaşım desteğini başlatma ve gerektiğinde artırma kapasitesine sahip, kardiyak girişimleri uygulayabilen ve bünyesinde kardiyak yoğun bakım üniteleri ile kalp cerrahisi olanakları bulunan uzmanlaşmış üçüncü basamak merkezlerde tedavi edilmelidir.²²,³⁰ Gözlemsel çalışmalar, yıllık ortalama kardiyojenik şok vaka sayısı en yüksek çeyrekte (≥107 vaka/yıl) yer alan merkezlerde mortalitenin daha düşük olduğunu göstermiştir.³¹,³² Buna ek olarak; genellikle yoğun bakım uzmanları, girişimsel kardiyologlar, perfüzyonistler ve kalp-damar cerrahlarından oluşan deneyimli multidisipliner şok ekiplerinin iş birliği ile bölgeselleştirilmiş şok bakım sistemleri, sonuçların iyileştirilmesinde bağımsız bir faktör olabilir.³³,³⁴
Genel Yoğun Bakım Ünitesi Tedavisi
Yoğun bakım ünitesindeki tedavi, kılavuzlar tarafından önerilen destekleyici yaklaşımlara uygun olarak yürütülmelidir; bunlar arasında kan glukoz düzeyinin kontrolü, stabilizasyon sağlanıncaya kadar yüksek sıklıkta (saatte bir) yapılan laktat ölçümleri, yeterli oksijen sunumu, tromboprofilaksi, stres ülseri profilaksisi ve başlangıç stabilizasyonu sonrası erken enteral beslenme yer alır.³⁵ Tüm vazoaktif ilaçlar intravenöz yoldan verilmelidir. Mekanik ventilasyon kullanılıyorsa, mümkünse akciğer koruyucu stratejiler (öngörülen vücut ağırlığı başına 6–8 ml tidal volüm) uygulanmalıdır.³⁶ Sınırda durumlarda entübasyonu önlemek için sürekli pozitif havayolu basıncı (CPAP) ile noninvaziv ventilasyon bir seçenek olabilir; ancak sağ kalp yetmezliğinin baskın olduğu durumlarda dikkatli olunmalıdır.
İdrar çıkışının ölçülmesi ve kreatinin düzeylerinin seri değerlendirilmesi yapılmalı; klinik üremi bulguları, başka şekilde tedavi edilemeyen volüm yüklenmesi, metabolik asidoz veya refrakter hiperkalemi bulunan akut böbrek yetmezliği hastalarında renal replasman tedavisi başlatılmalıdır. Bu geleneksel acil endikasyonlar olmaksızın renal replasman tedavisinin daha erken başlatılmasının sonuçlar üzerinde etkisi olmadığı gösterilmiştir.³⁷ Kardiyojenik şokla ilgili büyük çalışmalarda renal replasman tedavisi; IABP-SHOCK II (Intraaortic Balloon Pump in Cardiogenic Shock II) çalışmasında hastaların %18’inde,⁷ CULPRIT-SHOCK (Culprit Lesion Only PCI versus Multivessel PCI in Cardiogenic Shock) çalışmasında %14’ünde,⁸ ve ECLS-SHOCK (Extracorporeal Life Support in Cardiogenic Shock) çalışmasında %11’inde başlatılmıştır.⁴ DanGer Shock (Danish–German Cardiogenic Shock) çalışmasının bir analizinde, renal replasman tedavisinin diğer kardiyojenik şok çalışmalarına kıyasla daha erken başlatılmış olduğu görülmektedir.⁴,⁷,⁸,³⁸ Bununla birlikte, renal replasman tedavisinin başlatılması için en uygun zaman hâlâ net değildir.
Hemodinamik İzlem
Genel olarak ekokardiyografi — ya da en azından yatak başı ultrasonografi — kardiyojenik şokun nedenini belirlemek ve daha ileri fenotiplendirme yapmak için kullanılan ilk yöntemdir.³⁰,³⁹,⁴⁰ Günümüzde, kardiyojenik şokun değerlendirilmesi ve tedavisinin yönlendirilmesi için uygun invaziv hemodinamik izlem yöntemi konusunda bir görüş birliği bulunmamaktadır. Kılavuzlar ve bilimsel bildiriler, başlangıç tedavisine yanıt vermeyen seçilmiş hastalarda veya karma şok gibi tanısal ya da terapötik belirsizliğin bulunduğu durumlarda, tedavinin erken döneminde pulmoner arter kateterlerinin kullanılmasını önermektedir.²,³⁰,³⁹,⁴⁰
Kardiyojenik şokun etiyolojik faktörlerine ilişkin anlayış son on yılda değişmiş olup, sağ ventrikül veya biventriküler yetmezliğin prognozu etkilediği çeşitli hemodinamik profiller tanımlanmıştır.¹⁸ Bununla birlikte, pulmoner arter kateterlerinin (devam eden bir çalışmanın tanımı için Tablo 2’ye bakınız) veya diğer hemodinamik izlem yöntemlerinin sonuçlar üzerine fayda sağladığını gösteren randomize çalışmalardan elde edilmiş veriler henüz mevcut değildir.
Kardiyojenik Şokta Farmakolojik Tedavi
Sıvı Yönetimi
Santral hipovolemisi olan, ancak konjesyonu bulunmayan ve bacak kaldırma testi (leg-raise test) sonrasında hemodinamikleri düzelen hastalarda kristaloid solüsyonların verilmesi hemodinamikleri iyileştirebilir.⁴¹ Hacim yüklenmesi olan durumlarda intravenöz loop diüretikleri sıvı retansiyonunu ve pulmoner ödemi azaltabilir. Hipovolemiden kaçınmak kritik öneme sahiptir ve sıvı yönetimi patofizyolojik değerlendirmeye dayanmalıdır; sağ ventrikül baskın veya sol ventrikül baskın yetmezlik durumlarına göre farklılık gösterebilir.⁴²
İnotroplar ve İnodilatörler
Kontraktilite inotrop tedavisi ile artırılabilir; ancak bu ajanların klinik sonuçlar üzerindeki etkisi iyi tanımlanmamıştır. İlk basamak inotrop seçimi konusunda net bir görüş birliği yoktur³⁰,³⁹,⁴⁰ ve kardiyojenik şokta inotrop seçimi klinikler arasında büyük değişkenlik göstermektedir.⁴³ Sol ventrikül yetmezliği olan hastalarda dobutamin sıklıkla birincil inotrop olarak kullanılsa da, dobutamin etkisiz kaldığında levosimendan ve milrinon gibi fosfodiesteraz-3 inhibitörleri alternatif veya ek seçenekler olabilir. Bir Cochrane analizi, mortalite açısından herhangi bir inotropun üstünlüğünü ortaya koymak için yeterli kanıt olmadığını göstermiştir.⁴⁴ Randomize bir çalışmada milrinon ile dobutamin arasında sonuçlar açısından fark saptanmamıştır.¹⁰ Kalsiyum duyarlılaştırıcısı olan levosimendan, kardiyak inotropiyi artırır ve afterload’u azaltır.³⁰ Ancak yakın tarihli randomize bir çalışmada levosimendan, venoarteriyel ekstrakorporeal membran oksijenasyonundan (ECMO) ayırmayı kolaylaştırmamıştır.⁴⁵ Kardiyojenik şokta diğer randomize çalışmaların sonuçları henüz mevcut değildir; ancak ilgili devam eden klinik çalışmalar vardır (Tablo 2).
Tablo 2 Kardiyojenik şokta devam eden veya sonlanmış çalışmalar
|
Çalışma ve No |
Şok Tipi |
Girişim (Deneysel) |
Kontrol |
Örneklem |
Primer Sonlanım Noktası |
Açıklamalar |
|
Mekanik dolaşım desteği |
||||||
|
ECMO-RRT (NCT02870946) |
AMI + HF |
VA-ECMO + RRT |
VA-ECMO |
362 |
30 günde mortalite |
|
|
HEMO ECMO (NCT01484635) |
AMI + HF |
VA-ECMO + hemofiltrasyon |
VA-ECMO |
60 |
30 günde mortalite |
|
|
ANCHOR (NCT0366452) |
AMI |
VA-ECMO + IABP |
En iyi medikal tedavi |
400 |
30 günde mortalite |
|
|
UNLOAD-ECMO (NCT03525795) |
AMI + HF |
VA-ECMO + Impella CP |
VA-ECMO |
198 |
30 günde mortalite |
Laktat ≤5 mmol/L |
|
ULYSIS (NCT03536452) |
AMI |
Impella CP |
En iyi medikal tedavi |
204 |
30 günde Tüm nedenlere bağlı ölüm, ölüm, ECMO, LVAD veya kalp nakli |
|
|
RECOVER IV (NCT0590905) |
AMI |
Impella CP |
En iyi medikal tedavi |
558 |
30 günde mortalite |
Erken sonlandırıldı (güvenlik) |
|
ICONIE (NCT0590905) |
AMI + HF |
VA-ECMO sırası kişiye özel IV destek |
VA-ECMO sırası konvansiyonel IV destek |
138 |
VA-ECMO süresine göre ayarlanmış PRBC transfüzyon sayısı |
|
|
REMAP-ECMO (NCT04036202) |
AMI + HF |
VA-ECMO + IABP |
VA-ECMO |
430 |
VA-ECMO 30 günde başarılı weaning |
|
|
MINOS (NCT03928124) |
AMI + HF |
M-TEER |
En iyi medikal tedavi |
144 |
Hastane içi her hangi sebepten mortalite,kalp nakli,uzun süreli LVAD veya palyatif inotropla taburculuk |
Evre 3+ veya 4+ mitral yetersizlik |
|
RESCUE-SHOCK (NCT02527777) |
AMI |
Acil çok damar PCI + VA-ECMO |
Sadece suçlu damar PCI + VA-ECMO |
560 |
90 günde herhangi sebepten mortalite, kalp nakli, LVAD kompoze son nokta |
|
|
Çalışma |
Hasta Grubu |
Girişim |
Kontrol |
Hasta |
Primer Sonlanım Noktası |
Açıklamalar |
|
İnotroplar, vazopresörler ve hemodinamik ajanlar |
||||||
|
Levo Heart Shock (NCT04206263) |
AMI + HF |
Levosimendan |
Plasebo |
610 |
Herhangi sebepten mortalite, kalp nakli veya dializ kompoze son nokta |
|
|
CAPITAL DOREMI-2 (NCT05267886) |
AMI + HF |
Dobutamin veya Milrinon |
Plasebo |
346 |
Hastane içi herhangi bir nedene bağlı ölüm ile aşağıdaki durumlardan herhangi birinin, girişimin başlamasından sonraki ≤12 saat içinde gelişmesinin bileşkesi:
(MAP ≤55 mmHg) veya yüksek doz vazopresör gereksiniminin devam etmesi
|
SCAI şok C veya D |
|
Norshock (NCT05186462) |
AMI |
MAB ≥55 mmHg |
MAB ≥65 mmHg |
776 |
Herhangi bir nedene bağlı ölüm ile renal replasman tedavisi gerektiren ağır böbrek yetmezliğinin bileşkesi |
|
|
PACCS (NCT04583576) |
HF |
PAC kullanımı |
PAC yok |
400 |
Hastane içi mortalite |
Laktat > 2 mmol/L |
|
Sistemik yaklaşımlar ve antiplatelet ajanlar |
||||||
|
DAPT -SHOCK (NCT03551964) |
AMI |
Cangrelor + Tikagrelor ile DAPT |
Standart DAPT |
605 |
Laboratuvar sonlanım noktası: trombosit reaktivite indeksi Klinik sonlanım noktası: MACE (Majör advers kardiyovasküler olaylar) |
Primer lab son nokta karşılandı klinik karşılanmadı |
|
DOBERMANN (NCT03535092) |
AMI şoku |
Toclizumab veya Dobutamin veya ikisi birden |
Plasebo |
400 |
< 48 saat NT-proBNP düzeyi |
2×2 faktöriyel tasarım; preshock hastalar, belirgin kardiyojenik şok olmayan; çift kör |
|
COCOA (NCT03773822) Tamamlandı |
AMI + HF |
Hidrokortizon + fludrokortizon |
Plasebo |
380 |
7. günde kortikosteroid tedavi olmayışı |
|
Kısaltmalar
- AMI: Akut miyokard enfarktüsü
- HF: Kalp yetmezliği
- VA-ECMO: Veno-arteriyel ekstrakorporeal membran oksijenasyonu
- IABP: İntraaortik balon pompası
- LVAD: Sol ventrikül destek cihazı
- RRT: Renal replasman tedavisi
- PCI: Perkütan koroner girişim
- DAPT; Dual antiplatelet tedavi
- TEER; Trans kateter edge to edge onarım
Vazopressörler
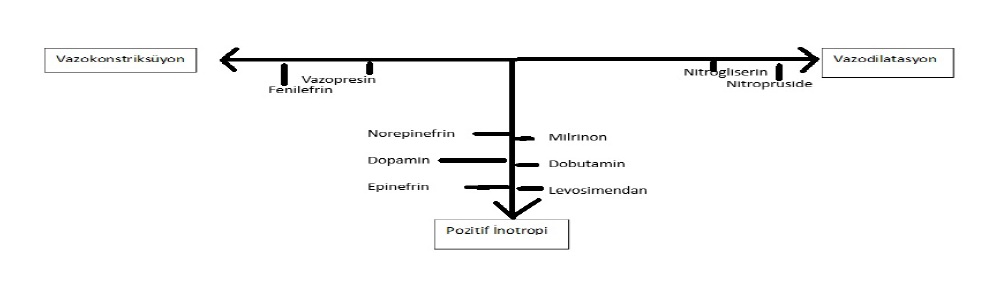
Çeşitli şok nedenleri olan 1679 hastanın yer aldığı randomize bir karşılaştırmada, dopamin tedavisi norepinefrine kıyasla belirgin derecede daha fazla aritmi ile ilişkili bulunmuş, ancak mortalite açısından fark saptanmamıştır.⁴⁶ Epinefrin ve norepinefrin kardiyak indeks üzerine benzer etkilere sahip olmakla birlikte, epinefrinin kalp hızı ve laktik asidoz dahil metabolik değişiklikler üzerindeki etkileri olumsuz bulunmuştur.⁴⁷ Bu bulgular, kan basıncı düşük ve doku perfüzyon basıncı yetersiz olduğunda norepinefrinin muhtemelen tercih edilecek vazokonstriktör olduğunu düşündürmektedir.⁴⁰ Kardiyojenik şokta vazopressinle ilgili çalışmalar bulunmamaktadır. Vazopressör tedavisi ile hedeflenen ortalama arter basıncı net olarak tanımlanmamıştır; genellikle 65 mm Hg’nin üzerindeki bir ortalama arter basıncı yeterli kabul edilir.²²,³⁰ Devam eden bir çalışmada, enfarktüsle ilişkili kardiyojenik şokta 55 mm Hg’lik bir ortalama arter basıncı hedefi, 65 mm Hg ile karşılaştırılmaktadır (Tablo 2). İnodilatörler ve vazopressörlerin hemodinamik etkileri Şekil 3’te gösterilmiştir.
Mekanik Dolaşım Destek Cihazları
Geçici perkütan mekanik dolaşım desteği, kardiyojenik şokta hemodinamikleri stabilize edebilir ve uç organ perfüzyonunu artırabilir.¹³ Mekanik dolaşım desteğinin genel kavramları; karar aşamasına köprü (bridge to decision), iyileşmeye köprü (bridge to recovery), kalıcı sol ventrikül destek cihazına köprü (bridge to durable left ventricular assist device) veya kalp nakline köprü (bridge to heart transplantation) şeklindedir.
Çeşitli mekanik dolaşım destek modları, oksijenasyonlu veya oksijenasyonsuz kısmi ya da tam dolaşım desteği sağlayabilir; bu cihazlar farklı mekanizmalarla çalışır, farklı düzeylerde hemodinamik destek sunar ve her birinin kendine özgü potansiyel yararları ile komplikasyonları vardır (Şekil S1).¹³ Her cihazın risk–fayda profilinin kapsamlı biçimde anlaşılması, farklı nedenlere ve farklı evrelere sahip kardiyojenik şokun yönetiminde bu cihazın rolünü belirlemek açısından kritik öneme sahiptir. Tekil cihazlara ek olarak, pulmoner destek gibi özel gereksinimleri karşılamak üzere cihaz kombinasyonları da uygulanabilir.⁴⁸,⁴⁹
İntraaortik Balon Pompası
Yerleştirilmesinin kolay olması, maliyetinin görece düşük olması ve yan etki profilinin elverişli olması nedeniyle intraaortik balon pompası (IABP) hâlâ yaygın olarak kullanılmaktadır.⁵⁰ İnen aortaya yerleştirilen bir IABP, diyastol sırasında koroner perfüzyonu artırır ve sistol sırasında afterload’u azaltır. Tıbbi tedavi ile karşılaştırıldığında, IABP’ler kardiyak indeksi veya diğer herhangi bir hemodinamik değişkeni artırmamış ve enfarktüsle ilişkili kardiyojenik şokta yapılan geniş ölçekli bir randomize çalışma, tıbbi tedaviye kıyasla sağkalım yararı göstermemiştir.⁷,⁵¹,⁵² Ayrıca, kalp yetersizliğine bağlı kardiyojenik şokta IABP kullanımı, randomize Altshock-2 (Study on Early Intra-aortic Balloon Pump Placement in Acute Decompensated Heart Failure Complicated by Cardiogenic Shock) çalışmasında sağkalımı veya kalp yerine koyma tedavisine (kalp nakli veya mekanik destek) başarılı köprülemeyi iyileştirmemiştir.⁵³ Bu veriler ışığında, enfarktüsle ilişkili kardiyojenik şokta IABP’nin rutin kullanımı önerilmemektedir; ancak Avrupa kılavuzlarında (ABD kılavuzlarında değil) enfarktüsle ilişkili mekanik komplikasyonları olan hastalarda bu cihazlar önerilmektedir.⁵⁴,⁵⁵
Venoarteriyel Ekstrakorporeal Membran Oksijenasyonu
Dakikada 6 litreye kadar akım desteği sağlayabilen venoarteriyel ECMO, sağ ve sol ventriküller için tam solunumsal ve dolaşımsal destek sunabilir.¹³ Periferik venoarteriyel ECMO’da venöz kanülasyon yapılır ve kanülün ucu sağ atriyumda yer alır; kan ekstrakorporeal bir pompa ve membran oksijenatöre yönlendirilir ve daha sonra inen aortaya retrograd şekilde geri verilir.⁵⁶ Venoarteriyel ECMO, kardiyojenik şoklu hastalarda giderek daha sık kullanılmaktadır.⁵⁶
Ağır enfarktüsle ilişkili kardiyojenik şoklu hastaları içeren yakın tarihli ECLS-SHOCK çalışması, erken rutin venoarteriyel ECMO’yu standart tedavi ile karşılaştırmıştır. Çalışmada, 30 günde tüm nedenlere bağlı ölüm oranı venoarteriyel ECMO grubunda %47,8, kontrol grubunda ise %49,0 olarak bulunmuş ve iki grup arasında anlamlı fark saptanmamıştır (göreli risk 0,98; %95 güven aralığı [GA], 0,80–1,19; P = 0,81);⁴ 1 yıllık izlemde de mortalite benzer bulunmuştur.⁵⁷ Çalışmaya dahil edilen hastaların önemli bir kısmının kardiyak arrest fenotipinde olması, muhtemelen bu nötr sonuçları açıklamaktadır. Bu bulgular, enfarktüsle ilişkili kardiyojenik şokta mortalite yararı göstermeyen ancak cihaz kullanımına bağlı daha fazla komplikasyon bildiren dört randomize venoarteriyel ECMO çalışmasının bireysel hasta verilerine dayalı bir meta-analiziyle uyumludur.⁵⁸ Günümüzde ABD kılavuzlarında kardiyojenik şokta venoarteriyel ECMO’nun rutin kullanımı önerilmemektedir.⁵⁵
Venoarteriyel ECMO cihazının kendisi bile, aortada retrograd kan akımı oluşturmasına bağlı afterload artışı nedeniyle kalbe zarar verebilir.⁵⁹ Mikroaksiyal akım pompaları veya IABP ile sol ventrikülün aktif olarak “boşaltılması” bu olumsuz hemodinamik etkileri azaltmayı amaçlar ve gözlemsel çalışmalar bu cihazlar kullanıldığında mortalitenin daha düşük olduğunu düşündürmektedir.⁶⁰,⁶¹ Ancak yakın tarihli bir randomize çalışmada, transseptal sol atriyal kanül ile yapılan rutin sol ventrikül boşaltımı venoarteriyel ECMO tek başına kullanımıyla karşılaştırıldığında mortalite üzerinde bir etki göstermemiştir.⁶² Ek randomize çalışma verileri halen geliştirilmektedir (Tablo 2).
Mikroaksiyal Akım Pompaları
Mikroaksiyal akım pompaları, perkütan olarak yerleştirilen bir kateter aracılığıyla yaklaşık dakikada 4,3 litre tepe akım sağlayabilir ve baskın sol ventrikül disfonksiyonu olan kardiyojenik şokun tedavisinde kullanılır. Mikroaksiyal akım pompaları, kardiyojenik şoklu hastaları içeren az sayıda randomize çalışmada⁶³ ve 100.000’den fazla hastayı kapsayan geniş ölçekli, eğilim eşleştirmeli (propensity-matched) çalışmalarda incelenmiştir; bu çalışmalar tutarlı biçimde sağkalım yararı olmadığını ve daha yüksek komplikasyon oranları olduğunu göstermiştir.⁶⁴–⁶⁶
Yakın tarihli DanGer Shock çalışması, hipoksik beyin hasarı riski olmayan ST-segment elevasyonlu miyokard enfarktüslü 360 hastayı içermiş ve mikroaksiyal akım pompası ile tedavi edilen hastalar ile standart tedavi (yani mikroaksiyal pompa olmaksızın, ancak belirli durumlarda mekanik dolaşım desteği uygulananlar) alan hastaların sonuçlarını karşılaştırmıştır; bu çalışmada pompa, 180 günde tüm nedenlere bağlı mortaliteyi daha düşük bulunmuştur (tehlike oranı [hazard ratio] 0,74; %95 güven aralığı [GA], 0,55–0,99; P = 0,04).⁹ Bu sağkalım yararının 10 yıla kadar sürdüğü, zaman içinde orantılı tehlike oranlarının kalıcı bir etkiyi düşündürdüğü bildirilmiştir.⁶⁷
Bununla birlikte, bu çalışmada mikroaksiyal akım pompası grubunda kontrol grubuna kıyasla kanama, ekstremite iskemisi ve renal replasman tedavisi insidansının daha yüksek olduğu da rapor edilmiştir.³⁸ Seçilmiş sol ventrikül baskın kardiyojenik şoklu hastalarda mikroaksiyal akım pompasının yararını göstermesine rağmen,⁹,⁶⁸ uygun hasta seçimi ve komplikasyonların önlenmesine ilişkin tartışmalar sürmektedir.⁶⁹,⁷⁰ Güncel ABD kılavuzları, mikroaksiyal akım pompasının seçilmiş hastalarda Sınıf IIa endikasyonla kullanılmasını önermektedir.⁵⁵
Enfarktüsle ilişkili kardiyojenik şokta mikroaksiyal akım pompalarını araştıran iki başka çalışma başlatılmıştır; ancak bunlardan biri, DanGer Shock çalışmasının sonuçları yayımlandıktan sonra bir veri ve güvenlik izleme kurulu tarafından durdurulmuştur (Tablo 2).
Sol Atriyumdan Femoral Artere Destek Sağlayan Cihazlar
Sol atriyumdan femoral artere akım yönlendiren TandemHeart mekanik dolaşım destek cihazı, venoarteriyel ECMO veya mikroaksiyal akım pompalarına kıyasla klinik pratikte nadiren kullanılmaktadır. Bu cihaz sol ventrikülü boşaltır ve dakikada 4 litreye kadar pompa akımı ile kalbi destekleyebilir. Ağırlıklı olarak enfarktüsle ilişkili kardiyojenik şoklu hastaların dahil edildiği iki küçük çalışmada incelenmiş olup, klinik sonuçlar açısından kesin bir yarar gösterilememiştir.⁶³
Dolaşım Desteği
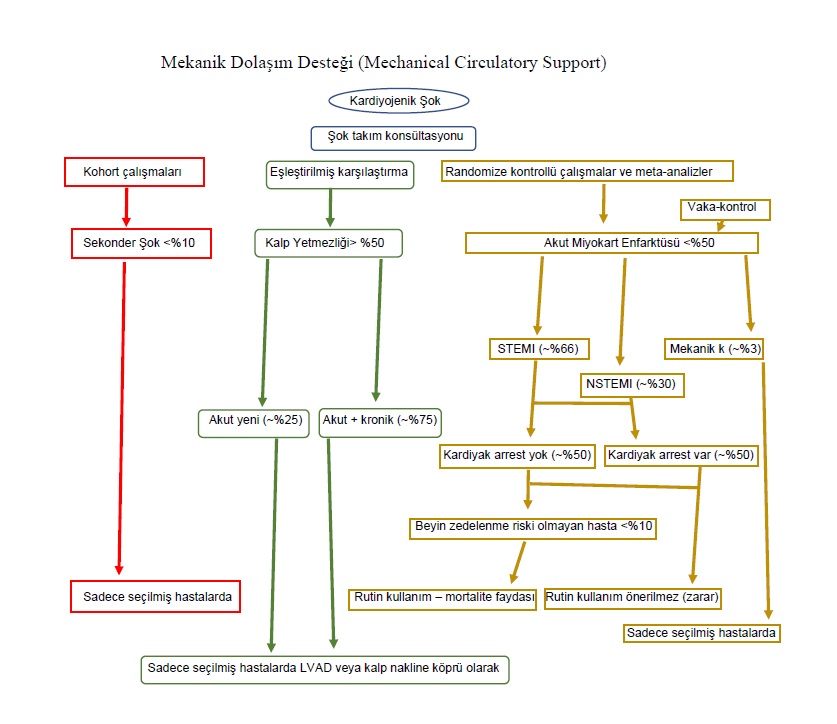
Kardiyojenik şokta geçici mekanik dolaşım desteği için hasta seçimi, klinik sonuçlar açısından olası bir yararı belirlemenin anahtarıdır.⁷¹ Mekanik dolaşım desteğinin kullanımı; uzman görüşleri, uygulayıcı deneyimi ve sağlık hizmeti geri ödeme politikaları gibi birçok faktörden etkilenerek değişkenlik gösterir.⁷¹ Uygun hasta ve cihaz seçimi ayrıca etkinlik, kurum deneyimi ve cihaza bağlı komplikasyonlar arasındaki denge tarafından da belirlenir. Günümüzde enfarktüsle ilişkili kardiyojenik şoklu hastaların yaklaşık %50–60’ı herhangi bir mekanik dolaşım destek cihazı kullanılmaksızın sağ kalmaktadır.⁴,⁷–⁹,⁷¹ Bu hastalarda söz konusu cihazların kullanımı, ölüme kadar gidebilen cihaza bağlı komplikasyonlara yol açma potansiyeline sahiptir.
Mekanik dolaşım desteği olmaksızın kardiyojenik şoku atlatamayan %40–50’lik hasta grubunda ise, ağır şok, ileri yaş ve kırılganlık gibi durumlarda cihazların mortaliteyi iyileştirmediği; anoksik beyin hasarı gibi durumlarda ise mevcut en iyi cihazların bile sonucu değiştiremediği görülmektedir. Yakın tarihli bir kayıt analizinde, kardiyojenik şok nedeniyle yatırılan tüm hastaların yalnızca %5’inin ve ST-segment elevasyonlu miyokard enfarktüsüne bağlı kardiyojenik şoklu hastaların %32’sinin, DanGer Shock çalışmasının uygunluk kriterlerine göre mekanik dolaşım desteği için uygun aday olarak değerlendirildiği bildirilmiştir.⁷²
Enfarktüsle ilişkili kardiyojenik şoklu hastalarda mekanik dolaşım desteğinin sonuçlar üzerindeki etkisine ilişkin ek kanıtlar, dokuz çalışmadan 1059 hastanın bireysel düzeyde verilerinin dahil edildiği ve 6 aya kadar uzatılmış izlem süresi bulunan bir meta-analizden elde edilmiştir.⁷¹ Genel olarak, mekanik dolaşım desteği ile kontrol girişimleri arasında mortalite açısından fark saptanmamıştır. Ancak sol ventrikül disfonksiyonu baskın fenotipe sahip ve hipoksik beyin hasarı riski düşük olan hastalarda geçici mekanik dolaşım desteği mortalite yararı sağlamıştır (tehlike oranı 0,77; %95 güven aralığı, 0,61–0,97; P = 0,024). Cihazdan bağımsız olarak, mekanik dolaşım desteği alan hastalarda komplikasyon oranları tutarlı biçimde daha yüksek bulunmuştur.
Kalp yetersizliğine bağlı kardiyojenik şoku inceleyen Altshock-2 çalışmasında, erken IABP yerleştirilmesi 60 günde sağkalımı veya kalp yerine koyma tedavisine köprülemeyi iyileştirmemiştir; ancak bu çalışmaya yalnızca 101 hasta dahil edilmiştir.⁵³ Bu hasta grubunda mekanik dolaşım desteğine ilişkin başka randomize çalışmalar bulunmamaktadır ve klinik uygulama yalnızca uzman görüş birliğine dayanmaktadır. Bu klinik ortamda, perkütan mekanik dolaşım desteği yalnızca miyokard iyileşme şansı olan veya kalıcı ventriküler destek cihazları ya da kalp nakli için uygun aday olan hastalarda düşünülmelidir.
Bazı veriler seçilmiş hasta alt gruplarında mekanik dolaşım desteğinin sonuçları iyileştirdiğini düşündürse de, belirli kardiyojenik şok fenotiplerini içeren daha fazla randomize çalışmaya ihtiyaç vardır. Kombine mekanik dolaşım desteği stratejilerinin risk ve yararları, mekanik dolaşım desteğinin artırılması ve azaltılması uygulamaları, komplikasyon yönetimi ve maliyetler konusunda da mevcut kanıtlar yetersizdir.
Kardiyojenik Şok Nedenlerinin Tedavisi
Akut Miyokard Enfarktüsünde Revaskülarizasyon
SHOCK (Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock) çalışması, erken revaskülarizasyonun başlangıçtaki tıbbi stabilizasyona kıyasla 30 günlük mortaliteyi azaltmadığını göstermiştir.⁵ Ancak daha uzun dönem sonuçlar, erken revaskülarizasyon ile mortalitenin (6 yıla kadar) azaldığını ortaya koymuştur.⁷³ Bu nedenle erken revaskülarizasyon, kılavuzlarda güçlü biçimde önerilmektedir.⁵⁴,⁷⁴ Çok sayıda kayıt çalışması, kardiyojenik şok bağlamında revaskülarizasyondaki gecikmenin daha kötü klinik sonuçlarla ilişkili olduğunu göstermiştir; bu bulgu, bu hasta grubunda ilk tıbbi temas ile balon şişirilmesi arasındaki sürenin (kapıdan balona süre, door-to-balloon time) kısaltılması için daha fazla çaba gösterilmesi çağrısına yol açmıştır.³⁹,⁴⁰
Bir gözlemsel çalışmada, ST-segment elevasyonlu miyokard enfarktüsü ile başvuran, kardiyojenik şoku olan ve hastaneler arası transport süresi uzun olan hastalarda, primer perkütan koroner girişime (PCI) kıyasla fibrinoliz içeren farmakoinvaziv yaklaşımın klinik yarar sağladığı gösterilmiştir. Bu farmakoinvaziv yaklaşım majör kanama artışı ile ilişkili bulunmamıştır.⁷⁵
Enfarktüsle ilişkili kardiyojenik şoklu hastaların büyük çoğunluğunda (%70–80) çok damar koroner arter hastalığı mevcuttur.²¹ CULPRIT-SHOCK (Culprit-Lesion-Only PCI versus Multivessel PCI in Cardiogenic Shock) çalışması, hemen yapılan çok damarlı PCI’ye kıyasla yalnızca suçlu lezyona yönelik PCI’nin klinik yarar sağladığını göstermiştir.⁸,⁷⁶ Suçlu lezyon-odaklı PCI grubunda ölüm ve renal replasman tedavisi oranı %45,9 iken, hemen çok damarlı PCI grubunda bu oran %55,4 olarak bulunmuştur (göreli risk 0,83; %95 güven aralığı, 0,71–0,96; P = 0,01); bu fark esas olarak mortalitedeki anlamlı azalmadan kaynaklanmıştır. CULPRIT-SHOCK çalışmasında suçlu lezyon-odaklı PCI grubunda hayatta kalan hastaların çoğunda izlem sırasında protokole uygun olarak evreli (staged) revaskülarizasyon yapılmıştır. Bu nedenle güncel olarak tercih edilen revaskülarizasyon stratejisi, klinik stabilizasyon sonrası evreli revaskülarizasyonla birlikte suçlu lezyon-odaklı PCI’dir.⁵⁴,⁵⁵,⁷⁴ Hastanın koroner anatomisi PCI için uygun değilse, koroner arter baypas greftleme cerrahisi düşünülebilir.⁵⁴,⁵⁵,⁷⁴
Mekanik ve Kapakla İlişkili Komplikasyonlar ile Giriş Yeri (Access) Konuları
Akut miyokard enfarktüsü sonrası papiller kas rüptürü, ventriküler septum duvarı veya serbest duvar rüptürü ya da defektleri gibi mekanik komplikasyonlar nadirdir ve görülme sıklıkları azalmaktadır; ancak ortaya çıktıklarında prognoz son derece kötüdür. Bu nedenle yaşamın sürdürülebilmesi için cerrahi veya perkütan düzeltme gereklidir.²⁰ Kapak hastalıklarına bağlı kardiyojenik şok, miyokardit ve deneysel anti-inflamatuvar tedaviler ile giriş yeri (access) konularına ilişkin ayrıntılar Ekler bölümünde (Supplementary Appendix) sunulmaktadır.
Gelecek Perspektifler
Genel olarak kardiyojenik şokta randomize çalışmaların yürütülmesi zordur ve yalnızca az sayıda çalışma, sonuçlardaki farkları saptayabilecek yeterli hasta sayısına ulaşabilmiştir (Tablo 1). Kardiyojenik şok fenotiplerinin çeşitliliği, çalışmalara hasta seçimini güçleştirir; bu durum tedavi yanıtlarında değişkenliğe yol açabilir ve nötr çalışma sonuçlarını da açıklayabilir. Bu nedenle, hangi hastaların belirli hedefe yönelik tedavilerden yarar görebileceğini anlamak için kardiyojenik şoklu hastalarda ileri fenotiplendirmenin çalışma tasarımında dikkate alınması gerekmektedir.
Hastalığın akut ve ağır doğası nedeniyle etik hususlar da bilgilendirilmiş onam süreçlerini zorlaştırmaktadır. Kardiyojenik şokta klinik çalışmaların önündeki zorluklara rağmen, bu tür çalışmaların başarıyla yürütülebileceği defalarca gösterilmiştir. Bu nedenle, tedaviye ilişkin çok sayıda açık soruyu yanıtlamak üzere geniş ölçekli şok araştırma ağlarının oluşturulması için uluslararası iş birlikleri gereklidir.
Kaynaklar;
1. Waksman R, Pahuja M, van Diepen S,et al. Standardized definitions for cardiogenicshock research and mechanical circulatory support devices: scientific expert panel from the Shock Academic Research Consortium (SHARC). Circulation 2023; 148: 1113-26.
2. van Diepen S, Poss J, Senaratne JM, Gage A, Morrow DA. Mixed cardiogenic shock: a proposal for standardized classification, a hemodynamic definition, and framework for management. Circulation 2024; 150: 1459-68.
3. Naidu SS, Baran DA, Jentzer JC, et al. SCAI SHOCK stage classification expert consensus update: a review and incorporation of validation studies. J Am Coll Cardiol 2022; 79: 933-46.
4. Thiele H, Zeymer U, Akin I, et al. Extracorporeal life support in infarct-related cardiogenic shock. N Engl J Med 2023; 389: 1286-97.
5. Hochman JS, Sleeper LA, Webb JG, et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. N Engl J Med 1999; 341: 625- 34.
6. TRIUMPH Investigators, Alexander JH, Reynolds HR, et al. Effect of tilarginine acetate in patients with acute myocardial infarction and cardiogenic shock: the TRIUMPH randomized controlled trial. JAMA 2007; 297: 1657-66.
7. Thiele H, Zeymer U, Neumann F-J, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 2012; 367: 1287-96.
8. Thiele H, Akin I, Sandri M, et al. PCI strategies in patients with acute myocardial infarction and cardiogenic shock. N Engl J Med 2017; 377: 2419-32.
9. Moller JE, Engstrom T, Jensen LO, et al. Microaxial f low pump or standard care in infarct-related cardiogenic shock. N Engl J Med 2024; 390: 1382-93.
10. Mathew R, Di Santo P, Jung RG, et al. Milrinone as compared with dobutamine in the treatment of cardiogenic shock. N Engl J Med 2021; 385: 516-25.
11. Kapur NK, Kanwar M, Sinha SS, et al. Criteria for defining stages of cardiogenic shock severity. J Am Coll Cardiol 2022; 80: 185-98.
12. Berg DD, Bohula EA, Patel SM, et al. Epidemiology of cardiogenic shock using the Shock Academic Research Consortium (SHARC) consensus definitions. Eur Heart J Acute Cardiovasc Care 2024; 13: 709-14.
13. Thiele H, Ohman EM, de Waha-Thiele S, Zeymer U, Desch S. Management of cardiogenic shock complicating myocardial infarction: an update 2019. Eur Heart J 2019; 40: 2671-83.
14. Redfors B, Angeras O, Ramunddal T, et al. 17-Year trends in incidence and prognosis of cardiogenic shock in patients with acute myocardial infarction in western Sweden. Int J Cardiol 2015; 185: 256-62.
15. Wayangankar SA, Bangalore S, McCoy LA, et al. Temporal trends and outcomes of patients undergoing percutaneous coronary interventions for cardiogenic shock in the setting of acute myocardial infarction: a report from the CathPCI Registry. JACC Cardiovasc Interv 2016; 9: 341-51.
16. Jamil Y, Park DY, Rao SV, et al. Association between frailty and management and outcomes of acute myocardial infarction complicated by cardiogenic shock. JACC Adv 2024; 3: 100949.
17. Berg DD, Singal S, Palazzolo M, et al. Modes of death in patients with cardiogenic shock in the cardiac intensive care unit: a report from the Critical Care Cardiology Trials Network. J Card Fail 2024; 30: 728-33.
18. Thayer KL, Zweck E, Ayouty M, et al. Invasive hemodynamic assessment and classification of in-hospital mortality risk among patients with cardiogenic shock. Circ Heart Fail 2020; 13(9): e007099.
19. Damluji AA, van Diepen S, Katz JN, et al. Mechanical complications of acute myocardial infarction: a scientific statement from the American Heart Association. Circulation 2021; 144(2): e16-e35.
20. Schlotter F, Huber K, Hassager C, et al. Ventricular septal defect complicating acute myocardial infarction: diagnosis and management: a clinical consensus statement of the Association for Acute CardioVascular Care (ACVC) of the ESC, the European Association of Percutaneous Cardiovascular Interventions (EAPCI) of the ESC and the ESC Working Group on Cardiovascular Surgery. Eur Heart J 2024; 45: 2478-92.
21. Kapur NK, Esposito ML, Bader Y, et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation 2017; 136: 314-26.
22. Zeymer U, Bueno H, Granger CB, et al. Acute Cardiovascular Care Association position statement for the diagnosis and treatment of patients with acute myocardial infarction complicated by cardiogenic shock: a document of the Acute Cardiovascular Care Association of the European Society of Cardiology. Eur Heart J Acute Cardiovasc Care 2020; 9: 183-97.
23. Beske RP, Sondergaard FT, Moller JE, et al. Treatment effects of blood pressure targets and hemodynamics according to initial blood lactate levels in comatose out-of-hospital cardiac arrest patients — a sub study of the BOX trial. Resuscitation 2024; 194: 110007.
24. Zeymer U, Freund A, Noc M, et al. Influence of resuscitated cardiac arrest on efficacy and safety of extracorporeal life support in infarct-related cardiogenic shock: a substudy of the ECLS-SHOCK trial. Circulation 2025; 151: 1752-4.
25. Auffret V, Cottin Y, Leurent G, et al. Predicting the development of in-hospital cardiogenic shock in patients with STsegment elevation myocardial infarction treated by primary percutaneous coronary intervention: the ORBI risk score. Eur Heart J 2018; 39: 2090-102.
26. Kresoja K-P, Rubini Gimenez M, Thiele H. The SEX-SHOCK score — the emperor’s new clothes? Eur Heart J 2024; 45: 4579-81.
27. Wang Y, Zeller M, Auffret V, et al. Sex-specific prediction of cardiogenic shock after acute coronary syndromes: the SEXSHOCK score. Eur Heart J 2024; 45: 4564- 78.
28. Poss J, Koster J, Fuernau G, et al. Risk stratification for patients in cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol 2017; 69: 1913-20.
29. Harjola VP, Lassus J, Sionis A, et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. Eur J Heart Fail 2015; 17: 501-9.
30. van Diepen S, Katz JN, Albert NM, et al. Contemporary management of cardiogenic shock: a scientific statement from the American Heart Association. Circulation 2017; 136(16): e232-e268.
31. Shaefi S, O’Gara B, Kociol RD, et al. Effect of cardiogenic shock hospital volüme on mortality in patients with cardiogenic shock. J Am Heart Assoc 2015; 4(1): e001462.
32. Barrionuevo-Sanchez MI, Viana-Tejedor A, Ariza-Sole A, et al. Impact of annual volume of cases and intensive cardiac care unit availability on mortality of patients with acute myocardial infarction-related cardiogenic shock treated at revascularization capable centres. Eur Heart J Acute Cardiovasc Care 2023; 12: 422-9.
33. Papolos AI, Kenigsberg BB, Berg DD, et al. Management and outcomes of cardiogenic shock in cardiac ICUs with versus without shock teams. J Am Coll Cardiol 2021; 78: 1309-17.
34. Tehrani BN, Truesdell AG, Psotka MA, et al. A standardized and comprehensive approach to the management of cardiogenic shock. JACC Heart Fail 2020; 8: 879-91.
35. Werdan K, Buerke M, Geppert A, Thiele H, Zwisler B, Rus M. Infarctionrelated cardiogenic shock — diagnosis, monitoring and therapy — a German- Austrian S3 guideline. Dtsch Arztebl Int 2021; 118: 88-95.
36. Writing Group for the PReVENT Investigators. Effect of a low vs intermediate tidal volume strategy on ventilatorfree days in intensive care unit patients without ARDS: a randomized clinical trial. JAMA 2018; 320: 1872-80.
37. Gaudry S, Hajage D, Schortgen F, et al. Initiation strategies for renal-replacement therapy in the intensive care unit. N Engl J Med 2016; 375: 122-33.
38. Zweck E, Hassager C, Beske RP, et al. Microaxial flow pump use and renal outcomes in infarct-related cardiogenic shock — a secondary analysis of the DanGer Shock trial. Circulation 2024; 150: 1990- 2003.
39. Heidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA guideline for the management of heart failure: a report of the American College of Cardiology/ American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2022; 145(18): e895-e1032.
40. McDonagh TA, Metra M, Adamo M, et al. Corrigendum to: 2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure: developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2021; 42: 4901.
41. Monnet X, Teboul J-L. Passive leg raising: five rules, not a drop of fluid! Crit Care 2015; 19: 18.
42. Harjola V-P, Mebazaa A, Čelutkienė J, et al. Contemporary management of acute right ventricular failure: a statement from the Heart Failure Association and the Working Group on Pulmonary Circulation and Right Ventricular Function of the European Society of Cardiology. Eur J Heart Fail 2016; 18: 226-41.
43. Tarvasmaki T, Lassus J, Varpula M, et al. Current real-life use of vasopressors and inotropes in cardiogenic shock — adrenaline use is associated with excess organ injury and mortality. Crit Care 2016; 20: 208.
44. Uhlig K, Efremov L, Tongers J, et al. Inotropic agents and vasodilator strategies for the treatment of cardiogenic shock or low cardiac output syndrome. Cochrane Database Syst Rev 2020; 11: CD009669.
45. Combes A, Saura O, Nesseler N, et al. Levosimendan to facilitate weaning from ECMO in patients with severe cardiogenic shock: the LEVOECMO randomized clinical trial. JAMA 2025 December 1 (Epub ahead of print).
46. De Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med 2010; 362: 779-89.
47. Levy B, Clere-Jehl R, Legras A, et al. Epinephrine versus norepinephrine for cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol 2018; 72: 173- 82.
48. Lusebrink E, Kellnar A, Krieg K, et al. Percutaneous transvalvular microaxial flow pump support in cardiology. Circulation 2022; 145: 1254-84.
49. Lusebrink E, Orban M, Kupka D, et al. Prevention and treatment of pulmonary congestion in patients undergoing venoarterial extracorporeal membrane oxygenation for cardiogenic shock. Eur Heart J 2020; 41: 3753-61.
50. Shah M, Patnaik S, Patel B, et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clin Res Cardiol 2018; 107: 287-303.
51. Thiele H, Zeymer U, Neumann F-J, et al. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II): final 12 month results of a randomised, open-label trial. Lancet 2013; 382: 1638-45.
52. Thiele H, Zeymer U, Thelemann N, et al. Intraaortic balloon pump in cardiogenic shock complicating acute myocardial infarction: long-term 6-year outcome of the randomized IABP-SHOCK II trial. Circulation 2019; 139: 395-403.
53. Morici N, Sacco A, Frea S, et al. Early intra-aortic balloon support for heart failure-related cardiogenic shock: a randomized clinical trial. J Am Coll Cardiol 2025; 85: 1587-97.
54. Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC guidelines for the management of acute coronary syndromes. Eur Heart J 2023; 44: 3720-826.
55. Rao SV, O’Donoghue ML, Ruel M, et al. 2025 ACC/AHA/ACEP/NAEMSP/SCAI guideline for the management of patients with acute coronary syndromes: a report of the American College of Cardiology/ American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol 2025; 85: 2135-237.
56. Lusebrink E, Binzenhofer L, Hering D, et al. Scrutinizing the role of venoarterial extracorporeal membrane oxygenation: has clinical practice outpaced the evidence? Circulation 2024; 149: 1033-52.
57. Desch S, Zeymer U, Akin I, et al. Routine extracorporeal life support in infarctrelated cardiogenic shock: 1-year results of the ECLS-SHOCK trial. Eur Heart J 2024; 45: 4200-3.
58. Zeymer U, Freund A, Hochadel M, et al. Venoarterial extracorporeal membrane oxygenation in patients with infarct-related cardiogenic shock: an individual patient data meta-analysis of randomised trials. Lancet 2023; 402: 1338-46.
59. Swain L, Bhave S, Qiao X, et al. Novel role for cardiolipin as a target of therapy to mitigate myocardial injury caused by venoarterial extracorporeal membrane oxygenation. Circulation 2024; 149: 1341-53.
60. Russo JJ, Aleksova N, Pitcher I, et al. Left ventricular unloading during extracorporeal membrane oxygenation in patients with cardiogenic shock. J Am Coll Cardiol 2019; 73: 654-62.
61. Schrage B, Becher PM, Bernhardt A, et al. Left ventricular unloading is associated with lower mortality in patients with cardiogenic shock treated with venoarterial extracorporeal membrane oxygenation: results from an international, multicenter cohort study. Circulation 2020; 142: 2095-106.
62. Kim MC, Lim Y, Lee SH, et al. Early left ventricular unloading or conventional approach after venoarterial extracorporeal membrane oxygenation: the EARLYUNLOAD randomized clinical trial. Circulation 2023; 148: 1570-81.
63. Thiele H, Jobs A, Ouweneel DM, et al. Percutaneous short-term active mechanical support devices in cardiogenic shock: a systematic review and collaborative meta-analysis of randomized trials. Eur Heart J 2017; 38: 3523-31.
64. Dhruva SS, Ross JS, Mortazavi BJ, et al. Association of use of intravascular microaxial left ventricular assist device vs intra-aortic balloon pump on in-hospital mortality and major bleeding among patients with acute myocardial infarction complicated by cardiogenic shock. JAMA 2020; 323: 734-45.
65. Schrage B, Schneider S, Zeymer U, Thiele H, Westermann D. Response by Schrage et al to letter regarding article, “Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock: A Matched-Pair IABP-SHOCK II Trial 30-Day Mortality Analysis.” Circulation 2019; 140(11): e559-e560.
66. Amin AP, Spertus JA, Curtis JP, et al. The evolving landscape of Impella use in the United States among patients undergoing percutaneous coronary intervention with mechanical circulatory support. Circulation 2020; 141: 273-84.
67. Moller JE, Beske RP, Engstrom T, et al. Long-term outcomes of the DanGer Shock trial. N Engl J Med 2025; 393: 1037-8.
68. Udesen NLJ, Beske RP, Hassager C, et al. Microaxial flow pump hemodynamic and metabolic effects in infarct-related cardiogenic shock: a substudy of the Dan- Ger Shock randomized clinical trial. JAMA Cardiol 2025; 10: 9-16.
69. Lusebrink E, Binzenhofer L, Thiele H. The DanGer Shock trial: a new dawn but much to uncover. Eur Heart J 2024; 45:4181-3.
70. Klein A, Beske RP, Hassager C, et al. Treating older patients in cardiogenic shock with a microaxial flow pump: is it DANGERous? J Am Coll Cardiol 2025; 85: 595-603.
71. Thiele H, Moller JE, Henriques JPS, et al. Temporary mechanical circulatory support in infarct-related cardiogenic shock: an individual patient data meta-analysis of randomised trials with 6-month follow-up. Lancet 2024; 404: 1019-28.
72. O’Brien CG, Brusca SB, Barnett CF, et al. Using selection criteria from the DanGer Shock trial in a contemporary cohort with cardiogenic shock. J Am Coll Cardiol 2024; 84: 2490-3.
73. Hochman JS, Sleeper LA, Webb JG, et al. Early revascularization and long-term survival in cardiogenic shock complicating acute myocardial infarction. JAMA 2006; 295: 2511-5.
74. Writing Committee Members, Lawton JS, Tamis-Holland JE, et al. 2021 ACC/AHA/ SCAI guideline for coronary artery revascularization: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol 2022; 79(2): e21-e129.
75. van Diepen S, Zheng Y, Senaratne JM, et al. Reperfusion in patients with STsegment- elevation myocardial infarction with cardiogenic shock and prolonged interhospital transport times. Circ Cardiovasc Interv 2024; 17(2): e013415.
76. Thiele H, Akin I, Sandri M, et al. Oneyear outcomes after PCI strategies in cardiogenic shock. N Engl J Med 2018; 379: 1699-710.