
Kardiyolojik hastalıkların nedenlerini anlamamız için kardiyolojik ekstraselüller matriksi iyi anlamış olmamız gerekiyor. Ekstra selüler matriks diğer organ yapılara göre küçümsenen değeri anlaşılmamış veya geç anlaşılmış önemli fonksiyonları olan bir ortamdır.
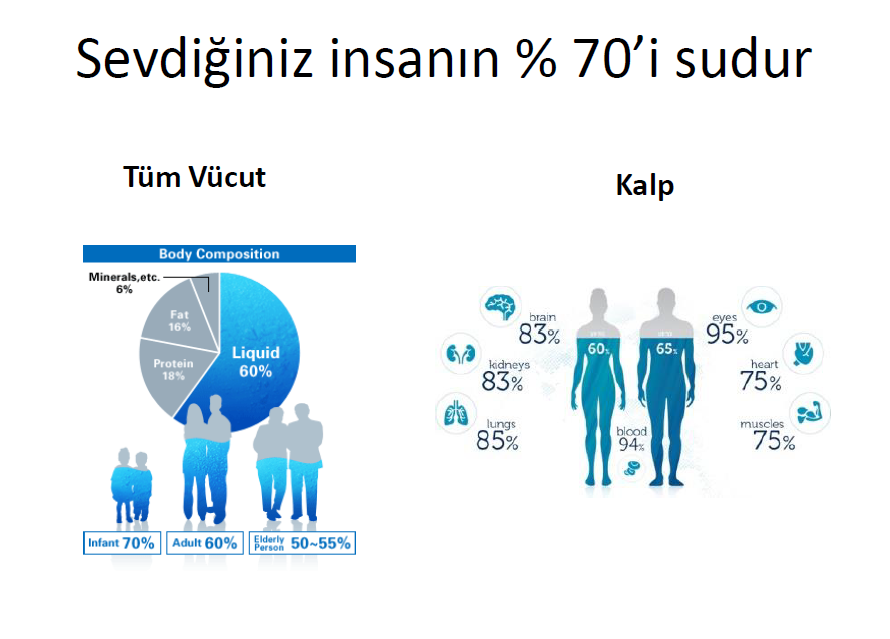
Klasik bilgimiz, vücudun büyük kısmının sıvı olduğu şeklindedir. Halbuki bu sıvı kısmın içindeki yapıların çok önemli fonksiyonları vardır. Sıvı miktarı çeşitli organlarda yüzde olarak değişmekle birlikte kalbimizde neredeyse % 75 lik kısmı oluşturur.

Kardiyovasküler sistemde ekstrasellüler matriksden bahsedereken temelde miyokardın, damar sisteminin ve kalp kapakçıklarının yapısından bahsediyoruz.
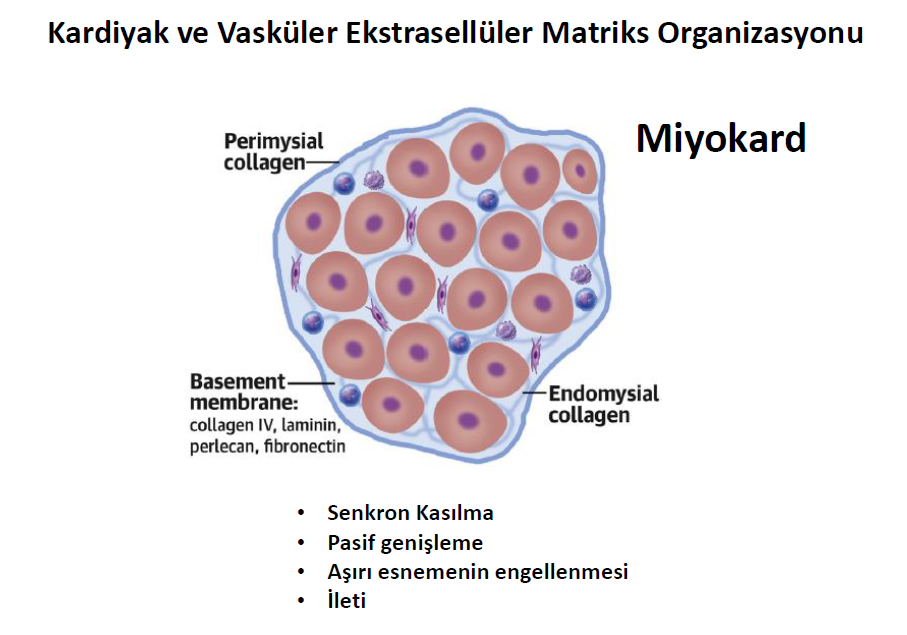
Miyokartda, kardiyomiyositlerin etrafını saran ekstraselüler matriks, senkron kasılma, pasif genişleme ve aşırı esnemenin engellenmesi gibi kalp kasılmasında hayati fonksiyonları düzenler, ayrıcak kasılmanın sayısını belirleyen yine ileti fonksiyonu gören ekstraselüler matriksdir.
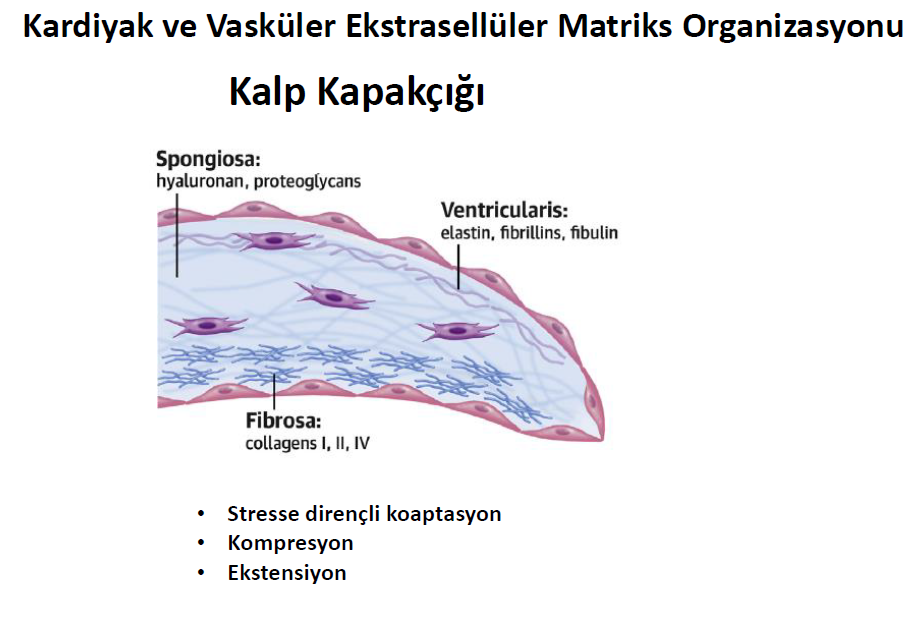
Yine kalp kapakçıklarında koaptasyonun sağlanmasında, kompresyona karşı dirençte ve esneyerek ekstensiyon yapabilme kabiliyetlerinde ekstraselüler matriks önemli görevler yapar.
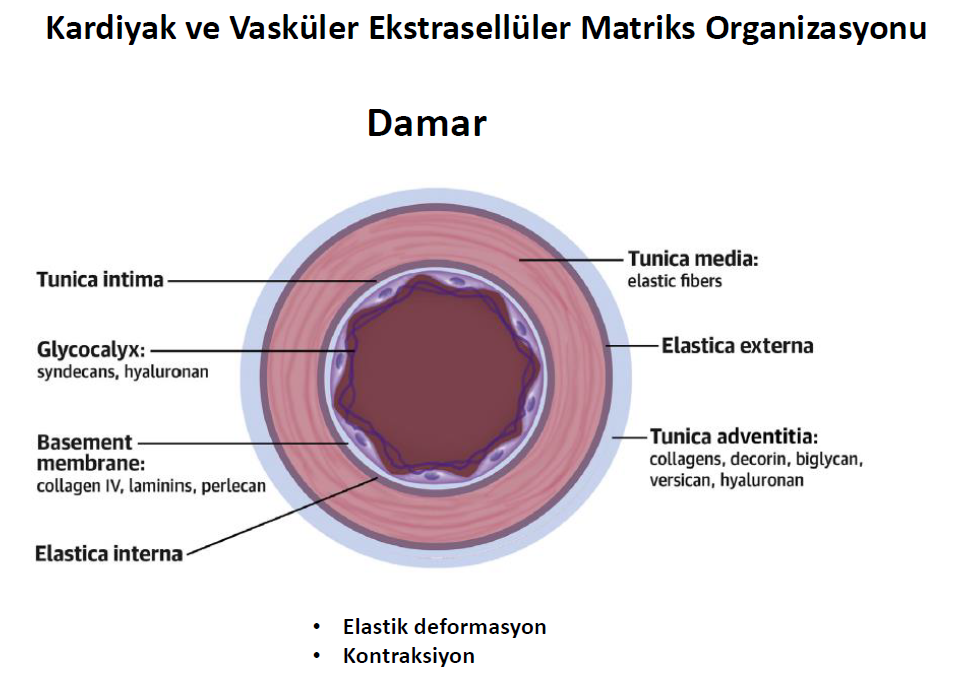
Yine damarların önemli fonksiyonu olan elastik deformasyon ve kontraksiyon fonksiyonları katmanlardaki ekstraselüler matriksin yardımı ile olmaktadır.

O zaman ekstraselüler matriks bir çok işlemi düzenleyen aktif, dinamik doku kompanentidir. Hücrelerin migrasyonu, dokuların progenitör hücreler ile yenilenmesi, yine hücrelerin farklı fonksiyon gören hücrelere farklılaşması, dokuların embriyojenik olarak büyümesi, morfogenezi bu doku kompanentinde gelişir. Ayrıca pek çok patoloji, zedelenme, yaşlanmada ekstraselüler matriksin payı olacaktır.

Ekstraselüler matriksin önemini kavraya bilmek için ilk önce embriyojenik gelişime bakmak gerekir.
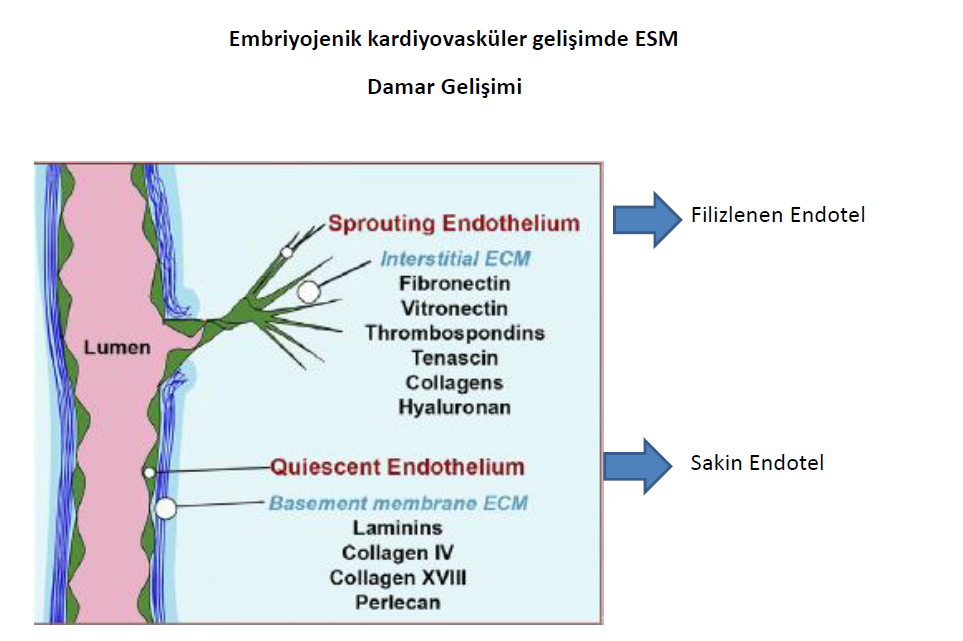
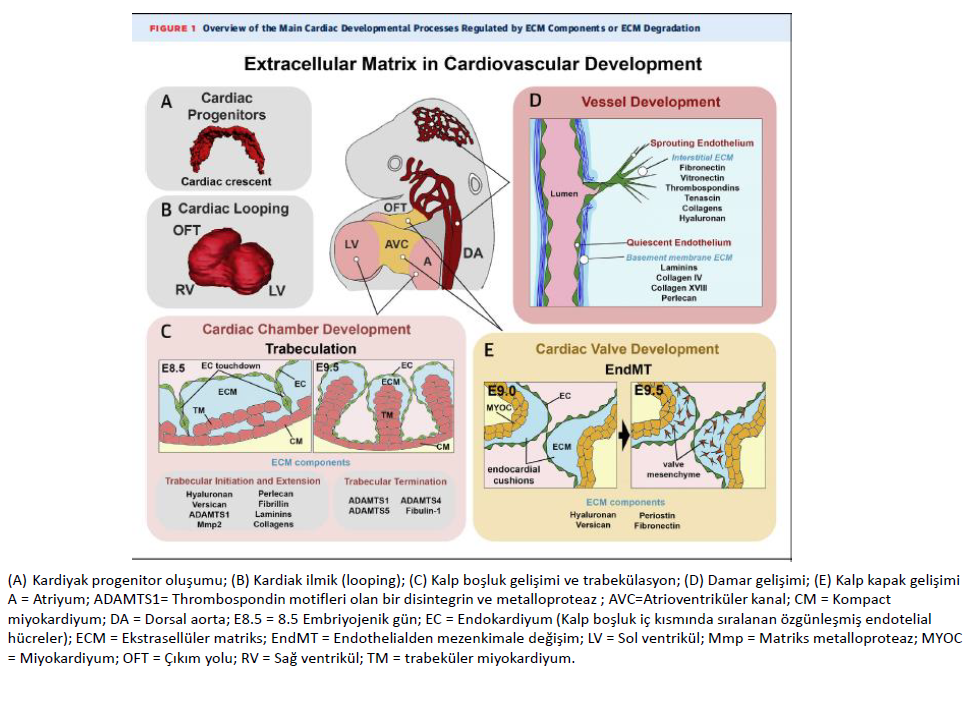
Damar sisteminin gelişmesinde rol alan endotelial progenitör hücrelerden (anjiyoblast) kordona benzer vasküler yapılar (vaskülogenez yolu ile) oluşur. İlk önce anjiyogenez yolu ile oluşan primitif damar yapılarından yeni damarlar filizlenir. Bu yeni oluşan damar yapılarının içinden, lamininler, kollajen IV ve XVIII, perlekan bulunur. Bu ekstraselüler matriks (ESM) elemanları bazal membranı ve komşu pasif endotelial hücrelerini oluşurturur. Anjiogenez ile yeniden yapılanan endotelial hücreler bazal membranı kırıp içeri girerek ESM içeriğindeki fibronectin, vitronectin, thrombospondin, tenascins, ve farklı kollajenler ile etkileşerek damarların filizlenmesine ve damar sisteminin gelişmesine sebep olurlar.
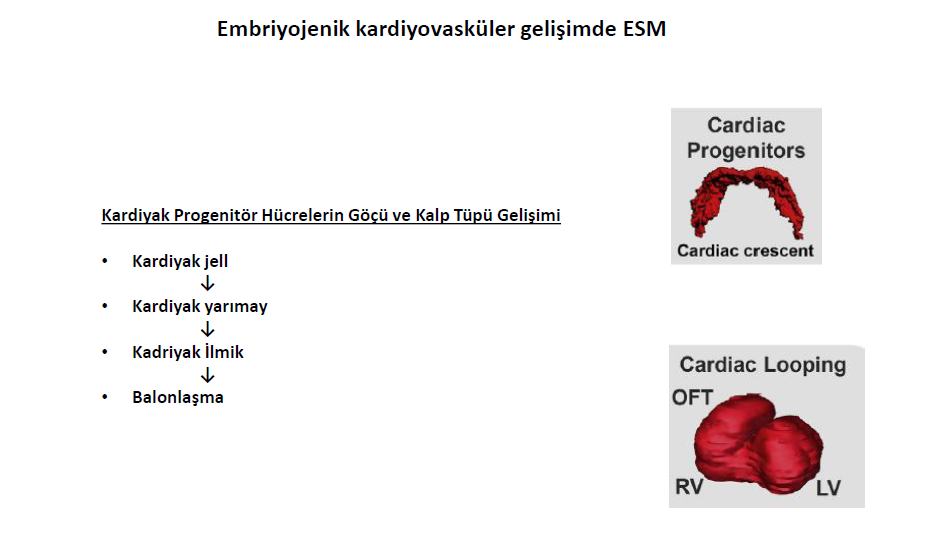
Primitif vertebrada kalp tüpü oluşurken, miyokardiyal ve endokardiyal progenitörler anteriorda yoğunlaşırlar, amniyonlu canlılarda bu bölgeye ‘kardiyak yarımay’ denir Kardiyak progenitör hücreler anterior endoderme, bitişik yüksek oranda hidrate ESM ile birbirinden ayrılmış olarak bulunurlar. Çift taraflı olarak organize olan progenitör hücreler embriyonik orta çizgiye göç edip birleşirler, burada oluşan kardiyak jelly denilen içinde miyokardiyal ve endokardiyal katmanları olan kalın ESM öncül kalp tüpünü oluşturur. Primitif kalp tüpü oluşumu hemen sonrasında, yaklaşık olarak düz olan kalp tüpü uzayıp kıvrılarak ilmik halinde bir tüp şekline gelir (Kadriyak looping). Bu kıvrılma sırasında oluşacak olan ventriküller farklılaşıp, prolifere olup genişlerler (balonlaşma).
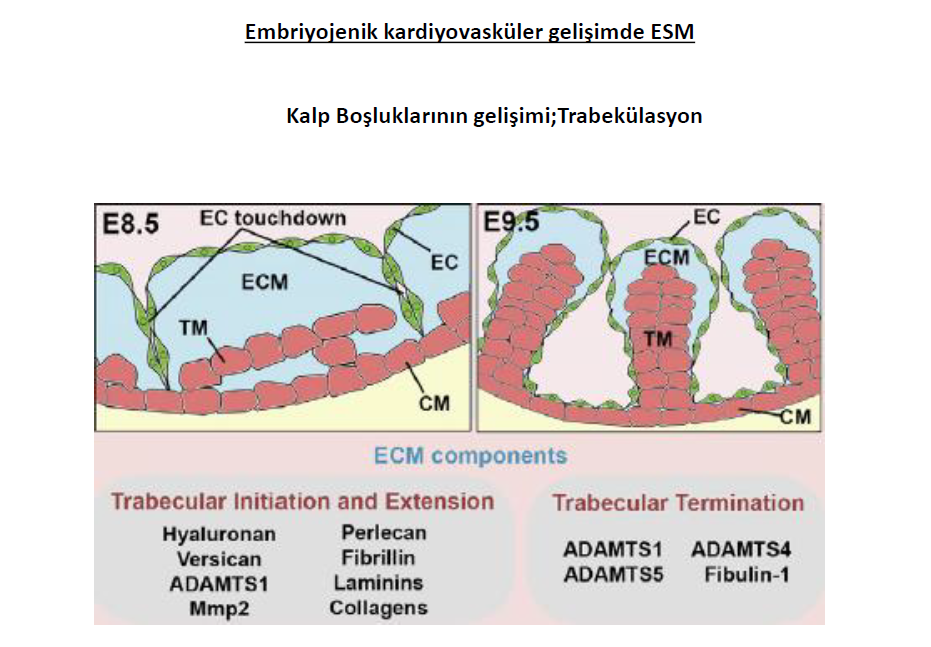
Gelişen kalpte boşlukların iç kısmında trabekülasyon gelişimi ile sünger benzeri özgül miyokart oluşması kalbin pompalama etkinliği ve yüzey alanını artırarak oksijen alışverişi ve beslenmesi için önemlidir. Primitif kalp tüpü oluşumu hemen sonrasında kalp boşluklarının oluşacağı bölgede kalp jelinde hızlı bir azalma olur. Özellikle kalp boşluklarındaki trabeküler çıkıntıların sonlanmasında ESM in metalloproteazları (ADAMTS1, ADAMTS4, ADAMTS5) ve metalloproteaz kofaktör fibulin 1 ile yıkımı önemli bir rol oynamaktadır. Adamts1 ve fibulin 1 mutasyonları, hypertrabeküler fenotipe ve normal terminasyonun ötesinde aşırı trabekülastona sebep olur. Tersine ektopik Adamts1, Adamts4 veya Adamts5 oluşumu ESM tamamen yıkımına, ve trabekülasyonun erken sonlanmasına neden olur.
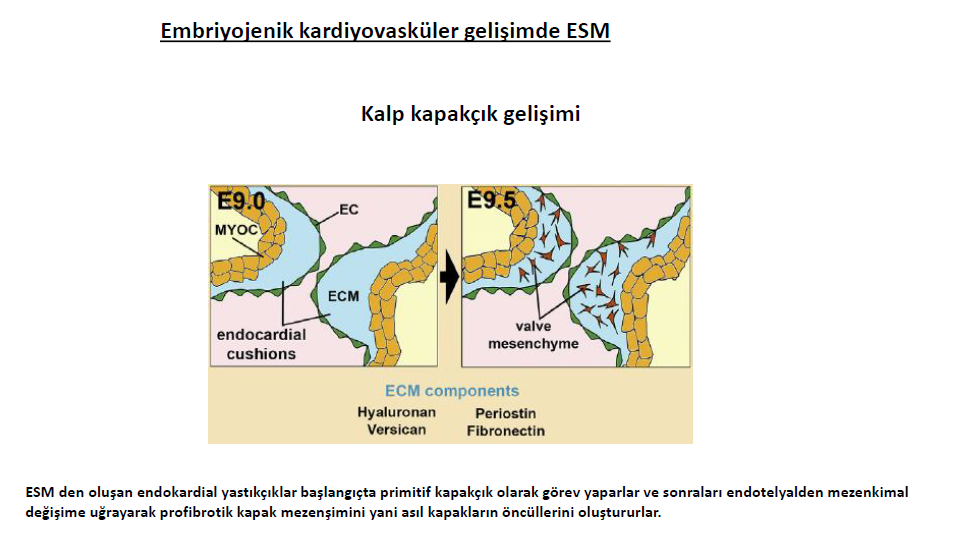
Yeni gelişen kalpte embriojenik ESM den oluşan kardiak jel homojen olmasına rağmen zaman içinde bölgesel farklılıklar belirecektir. Kapak bölgelerinin miyokart ve endokart tarafından aktif ESM sentezi artıp ve yıkımının azalması endokart ve miyokart arasında ‘endokardial yastıkçıklar’ denilen aselüller ESM şişkinliklerine sebep olur. Endokardial yastıkçıklar başlangıçta primitif kapakçık olarak görev yaparlar ve endotelyalden mezenkimal değişime uğrayarak (EndMT) profibrotik kapak mezenşimine dönüşürler. Yani asıl kapakların öncüllerini oluştururlar. Bu yastıkçıklar aynı zamanda kalp boşluklarını ayrıştırılıp, atrioventriküler septal komplex olarak bilinen ara bölgenin farklı doku elementleri ile örülmesini sağlarlar.
Embriyojenik kalp olgunlaştıkça, hyalurinik asit, kollajenler ve diğer ESM kompanentleri ve integrinler, talinler ve vinkulin gibi mekanosensitif adezyon kompleksleri sentezi artarak kalbin sertliği 10 kat artar. Kontraksiyonun sonucu olarak ESM de oluşan biomekanik gerginlik kollajen sentez ve organizasyonunu artırır.

Doğum hemen sonrasında apikal cerrahi rezeksiyon veya yapay MI geçirtilen fare kardiyomiyositleri güçlü regeneratif yanıt ile proliferasyon yeteneğini korurlar.Ancak faredeki bu regenerasyon özelliği ilk postnatal 1. hafta sonrasında kaybolur. Bu bir haftalık dönemde ESM de major değişiklikler meydana gelmesi, ESM nin rejenerasyon çalışmalarında önem kazanmasına sebep olmuştur. Agrin, çeşitli hücre tiplerinde kendini yenileme, proliferasyon ve diferansiyonel rol aldığı düşünülen büyük bir ESM heparan sülfat proteoglikan molekülüdür. Memelilerin fetal kalplerinde bulunan argin postnatal birinci haftada giderek azalır. Rekombinant agrin’in yetişkin fare kalbinde regenerasyonu ve kardiyomiyosit proliferasyonunu artırması‘kardiyak rejenerasyon tıbbı’için önemli bir bulgu olabilir.
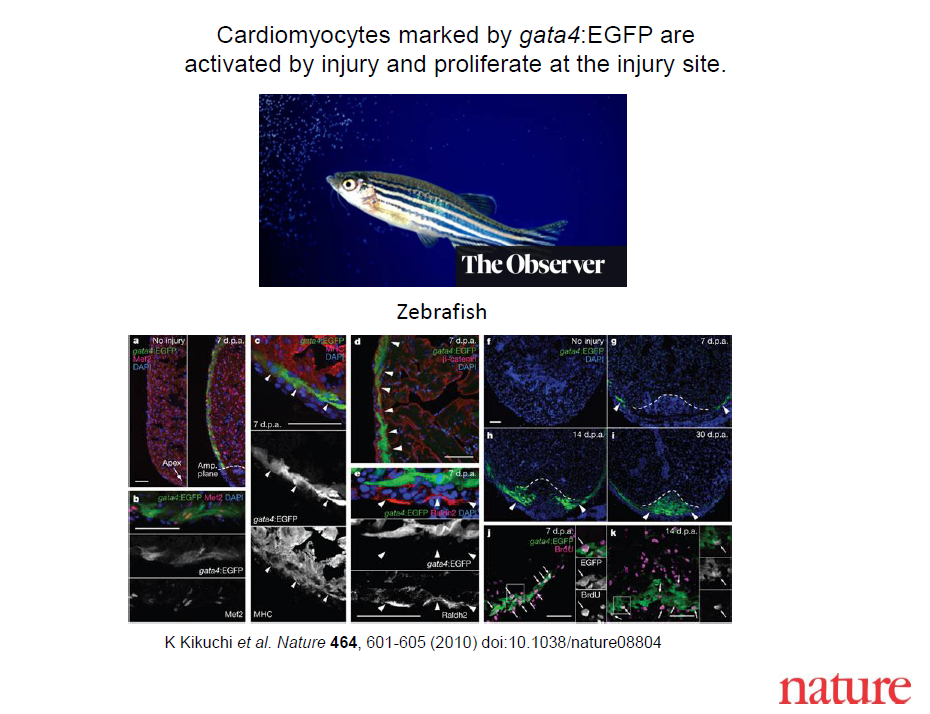
Zebra balığı miyokardı, tüm yaşam boyunca rejenerasyon yaparak kendini yenileme kabiliyetine sahiptir.

Yetişkinlerde ESM kompleksi, kardiyovasküler doku ve organların uygun fonksiyon görebilmesi için farklı fizyolojik ve patofizyolojik uyarılara karşı özgül mekanik yanıtlar veren, dinamik ve çok komponentli bir iletişim ağıdır. Mekanik stress, duvar gerilimi, duvar stressi ve farklı vasküler yataklardaki basınç farklılıkları ESM içeriği ve supramoleküler yapısını değiştirir.İntegrinler veya CD44 gibi özgül reseptörler ile ECM kardiyovasküler hücrelere sinyaller yollayarak büyüme faktörleri ve sitokinler için bağlanma noktaları sağlar.Bu sinyallerin fibroblast ve hatta kardiyomiyosit gibi kardiyovasküler hücrelerin fonksiyonlarını belirlemede kritik rol oynadığı düşünülür. Atheroskleroz, diyabet, basınç yükü, iskemik kalp hastalığı ve yaşlanmadaki pek çok patolojinin ESM yeniden yapılanmasından (remodeling) kaynaklandığı düşünülür.
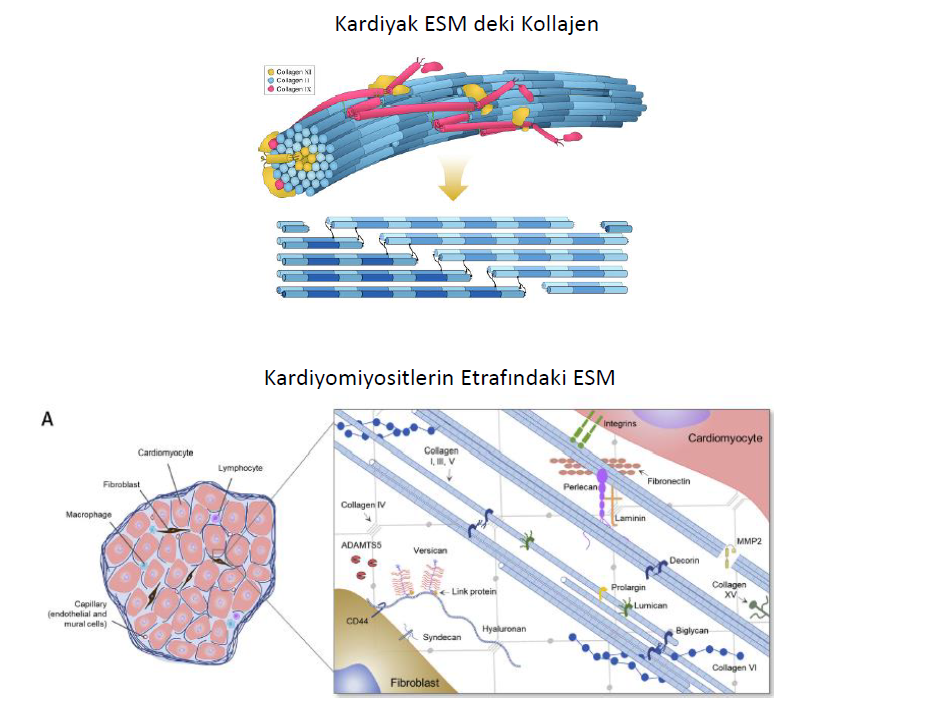
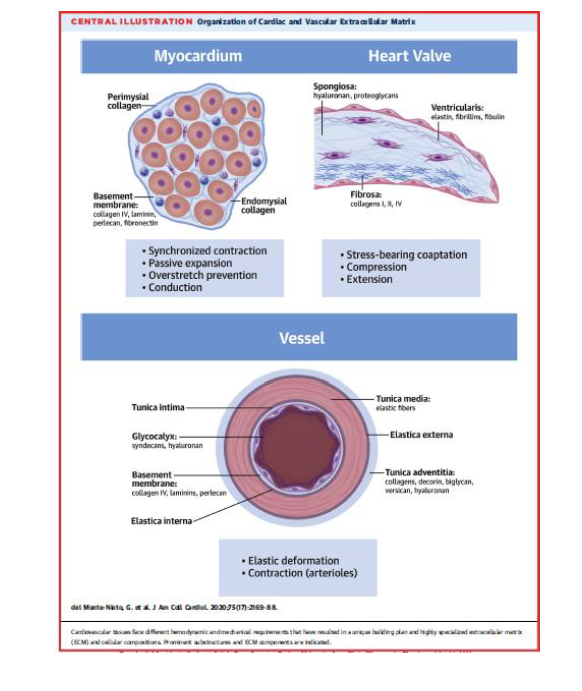
Yetişkin kardiyak ve vasküler ESM ağı kollajen, farklı proteoglikanlar, matriselüler proteinler ve hiyaluronan gibi glikozaminoglikanlardan oluşmaktadır. Basitçe kavrana bilinmesi için ESM yapısal (örneğin, kollajen ve elastin) ve yapısal olmayan ECM diye ikiye ayrıla bilir. Yapısal olmayan elemanlardan hyaluronan ve yapısındaki moleküllere bağlanan proteinler çeşitli hücre fonksiyonlarında rol oynar. Örneğin büyük bir kondrotin sülfat proteoglikanı olan versikan ile olan etkileşim, büyük hidrate çökertilere sebep olarak, hücrelerin göç etmesine ve burada prolifere olmasına sebep olur. Versikana fibronektin, tenascin R ve mikrofibriller gibi diğer ESM içeriklerine de bağlana bilir.Inflamasyon sırasında hyaluronana bağlanan tümör nekroz faktör stimule edici geni 6 (TSG6), ağır zincir 1 veya 2 ye (HC1,HC2) bağlanarak lökositlere yapışma özelliği kazanabilir. Kollajen kalpte en fazla bulunan ESM elemanıdır. Kollajen tip I, III, IV, V, and VI ise sağlıklı kalpte en çok bulunan kollajenlerdir. Kollajen ağ değişiklikleri kalp kasılmasında gevşemesinde, diyastolik sertlikte aynı zamanda iletim sisteminde önemlidir.
Endomesyum ve perimisyumdaki kollajenöz ESM, kardiyomiyosit dışı endotel hücreleri ve fibroblastlar için iskele görevi görürler. Her ne kadar kardiyomiyozitler kalp kitlesinin büyük kısmını oluştursada sayıca nonkardiyomiyozit hücreler olan endotel hücrelerinin ve fibroblastların kalpte en dominant halde olan hücreler olduğu gösterilmiştir. Endomysiumda bulunan fibroblastlar, kardiyomiyozitlerin çevresinde bulunan ESM in fizyolojik doğasının sağlanmasında görev alan hücrelerdir.



Vücudunuzda yaklaşık 5,6 litre (6 litre) kan vardır. Bu 5.6 litre kan vücutta her dakika üç kez dolaşır. Bir günde, kan toplam 19.000 km yol alıyor. Ancak sol ventrikül her sistolünde sadece 70 ml kanı yaklaşık 20 cm ileriye atabilmektedir. Kanın bu dolaşımı basınç iletimi ile kanı 0.3 saniyede damar ağının sonuna kadar ileten damarın esneyebilme kabiliyeti gerçekleştirmektedir.
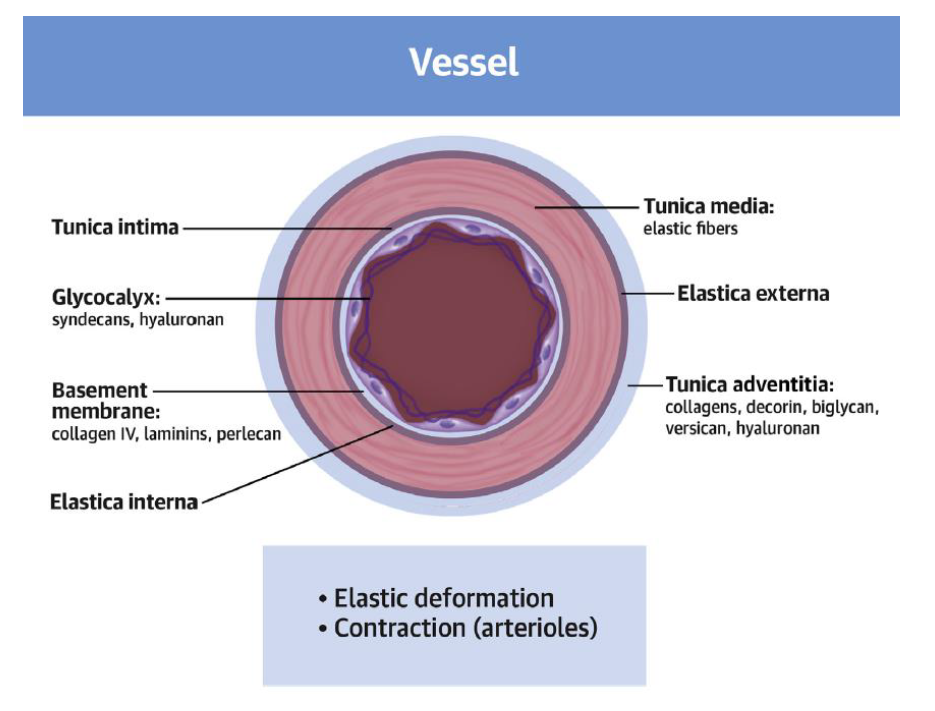
Tunica intima damarların lümen kısmını sınırlayan, kendi bazal memranı üstünde yerleşmiş, tek sıra halinde endotelial hücreleri ve proteoglikandan zengin subendotelial boşluğu içeren katmandır. Orta katman olan tunika media, intimadan internal elastik lamina ile ayrılır. Tunika media damar duvar dokusunun büyük kısmını oluşturur ve mekanik kompliansın ana belirleyicisidir. Tunika media temel olarak çevreleyici olarak düzenlenmiş vasküler düz kas hücreleri, kollajen ve elastinden oluşur. Vasküler düz adele hücreleri konsantrik olarak düzenlenmişlerdir. Elastik lamina ile diğer katmanlardan, ESM ile birbirinden ayrı olmalarına raağmen yine ESM ile birbirine yapışırarak ve diğer ESM yapıları ile etkileşime girerler. Bu özgül düzenleme sayesinde ESM, mekanik duyum ve kuvvet rezistansını düzenlediği düşünülen "elastik kontraktil ünite" kavramı ile duvar hemostazında temel rolü üstlenir. Tunika media arterin en dış katmanı olan tunika adventitia’dan eksternal elastic lamina ile ayrılır.Tunika adventia kollejenöz ESM, fibroblastlar, perivasküler sinirler, lenfatik damarlar, vazavozorum, inflamatuar hücreler içerir.Son zamanlarda vasküler kök hücre veya proginatör hücrelerin oluşumu için adventianın uygun bir ortam oluşturduğu kabul edilmiştir. Tunika adventitia’ nın yapısı arter büyüklüğü ve çapına göre değişir.
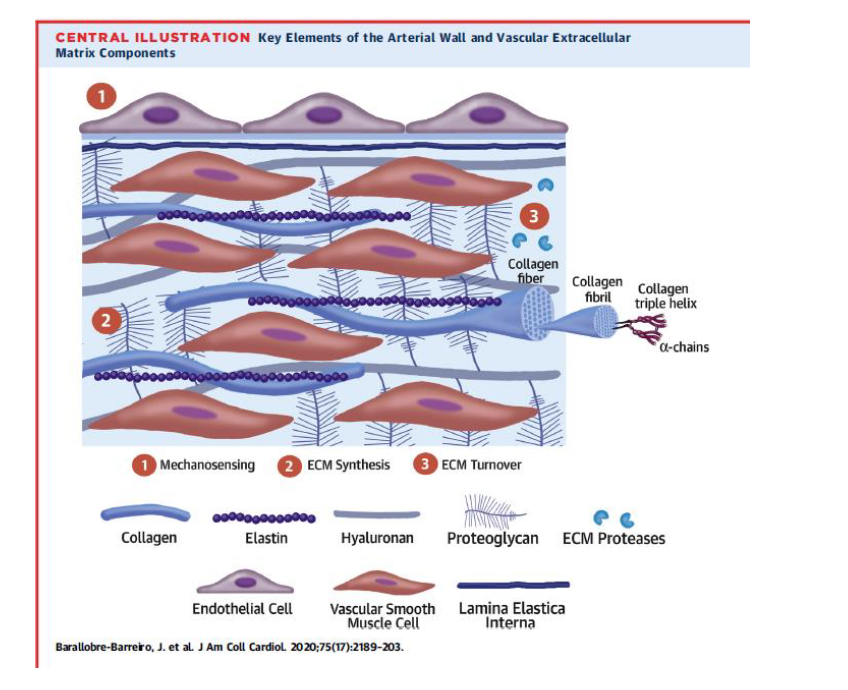
Gerekli kan basıncını korurken, damar duvarına uygulanan mekanik kuvvete vasküler düz adale hücrelerinin adaptasyonunu ürettiği ESM sağlar. Vasküler düz adele hüceleri arasında bulunan ,"matrizom" ismide verilen ESM in esası 300 farklı proteinden oluşmakla birlikte, damar duvarının temel mekanik veya viskoelastik yapısı ( yüksek elastikiyet, düşük histerez ve linear olmayan elastikiyet) 3 ana bileşen ile sağlanır : elastik fiberler, fibrillar kollajenler ve büyük proteoglikan çökertileri (aggrecan ve veriscan gibi). Damar duvar hemostazı için endotelial hücreler ve vasküler düz adele hücreleri ve onların içine gömüldükleri yüksek derecede iletişim içinde oldukları ESM ağı, hayati öneme sahiptir. Vasküler ESM içeriği ve yapısı yaşlanma ve mekanik stress (örneğin hipertansiyon) ile değişir, bu değişiklikler viskoelastikiteyi bozabilir.
Elastin
Elastik fibrinlerin ana bileşeni elastindir. Elastin üreten genin kesilmesi vasküler düz adele proliferasyonu ve aortanın tıkanması ile ölüm ile sonuçlanır. Bu deneyler elastinin vasküler düz adele proliferasyonunu engellediğini düşündürmüştür. Heterojen elastin defektli fareler hayatta kalmışlar ancak bu farelerde kan basıncı yüksekliği ve aortik kompliansda azalma izlenmiştir.
Kollajenler
Güçlü fibriller kollajenleri birbirine bağlayan elastin ,uzun çapraz bağlanmış fibriller oluşturarak arteriyel sertliği (sistol sırası damar duvarını deforme etmeye yetecek kuvveti kast eder) ve damar duvarının kuvvetini (damar duvar hasarı başlamadan uygulana bilecek maksimum kuvveti kast eder) sağlarlar. Mimari iskeleti oluşturan kollajenler ESM de karmakarışık bir ağ yapısı meydana getirirler. Üç polipeptid alfa zinciri, bir biri etrafına bükülerek kollajen triple heliksi oluşturur. Aortada kollajenlerin büyük kısmını tip I ve III dür. Media tabakasında tip III adventiada ise tip I hakim vaziyettedir. Farelerde tip I, III ve V mutasyonları vasküler yırtılma ile erken ölüme sebep olur.
Proteoglikanlar
Kollajnler deformasyona karşı gerilim kuvveti ile direnç sağlayıp damar deformitesini engelleyip bütünlüğünü korurken, elastin gerilebilirliği ve damar duvarındaki değişikliğin geri çekilip eski halini alarak tekrarlayan genişlemelere olanak sağlamaktadır.Proteoglikanlar glikozaminoglikan (GAG) yan zincirleri ile dekore edilmiş protein çekirdekleridir. Damar kasılma sonrası eski haline geldiği sıradaki zaman sürecinde yükün azalması sırası düşük nabız basıncı ve yeteri kadar nabız dalgası iletilmesi gereklidir. Damarın bu özelliği geniş ölçüde hyaluronanproteoglikan çökertileri (büyük proteoglikan çökertileri ) ile sağlanır ve damar vizkositesi adını alır. Büyük proteoglikan çökertileri döngüsünden disintegrin ve thrombospondin motifli metalloproteinase (ADAMTSs) denilen proteazlar sorumludur. Son zamanlarda ADAMTSs ların atheroskleroz ve anevrizma oluşumunda rol aldıkları çalışmalarda gösterilmiştir.

Uygun basınç devamlılığı için arter duvarı elastik ve vizköz yapılar içermektedir.,Hipertansiyon, damar sertliği, arterioskleroz, anevrizma oluşumu ve atherosklerozda gibi major vasküler hastalıklarda ESM dejenerasyonu ve yeniden yapılanması (remodeling) sıkça görülür. Arterioskleroz veya damar sertliği olarak da adlandırılan, arter duvarının dejeneratif sertliği hipertansiyona bağlı gelişir. Birlikte sık görülmelerine ve ilerleyici, diffüz ve yaşa bağlı süreçin her iki durumda da etkili olmasına rağmen arterioskleroz ile atheroskleroz birbiri ile karıştırılmamalıdır. Mikroskopik olarak sertleşen damarda kollajen tortusu, matriks metalloproteinaz ekspresyonu, parçalanmış ve azalmış elastin, organizasyonu bozulmuş endotel ve makrofaj ile mononükleer hücre infiltrasyonları arteriosklerozda görülür. Yaş ile arter duvarında kalsiyum tortularının arttığı ve bunun elastin fibrinlerine doğrudan kalsiyum iyonlarının bağlanması şeklinde olduğu görülür. Kompansatuar kollajen üretimi artar ancak bu kollajenin organizasonu zayıf ve çapraz bağlar kuvvetlidir (sert).
Hipertansiyon
Hipertansiyonlu hastalarda görülen ilk yapısal ve fonksiyonal değişiklik, damar yapıları üzerine yüklenen mekanik kuvvet sonucu kollajen miktarı ve çapraz bağlar üzerinden gerçekleşir. Hastalıklı ve sağlıklı arterler karşılaştırıldığında vasküler düz kas hücrelerinin fenotipik olarak kontraktil yapıdan, sentez yapan yapıya evrildikleri ve aggrekan/versikan-tipi proteoglikanların artarak daha sıvılaşmış ESM yapısının damar duvarı viskozitesini sağladığı gözlenir. Proteoliz artmıştır ve bu elastini parçalara ayırır. Bu elastikiyetteki azalma veya mekanik stresdeki artış, damar sertliğine katkıda bulunan artan kollajen çapraz bağları ile kompanse edilir.
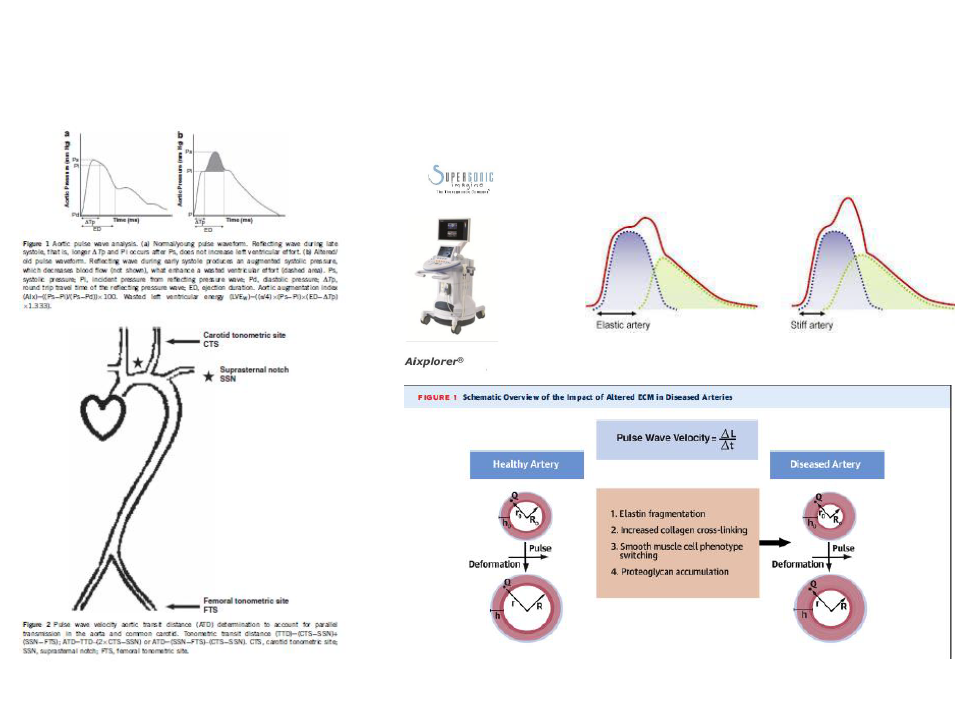
Damar sertliğinin klinikte ölçümü;
Damar sertliğinin klinik ölçümü pulse wave velocity (PWV) artışı ile saptanır. PWV = DL veya A ve B pozisyonu arasındaki mesafe / Dt veya nabız dalgasının A ile B pozisyonu arasında yolculuk süresi olarak ifade edilir . Sağlıklı damarlarda ventrikül kasılması ile oluşturulan basınç (DP) sonrası viskoelastik damarlarda deformasyon oluşmakta ve bunu diastol sonrası eskiye dönüş izlemekte bu sayede nabız dalgası ileriye doğru itilmektedir. Arter duvarı deformasyon ve geri dönüşümü (recoil), sistolik ve diyastolik damar kalınlığı (h0,h), damar lümen yarıçapı (R0,R), duvar kalınlığı ile birlikte lümen çapı (r0,r) ile saptanan arterial duvar boyutları (DA) ile belirlenmektedir. Nabız basıncındaki değişiklikler, ESM değişimi ile olan boyutlardaki değişime bağlıdır.
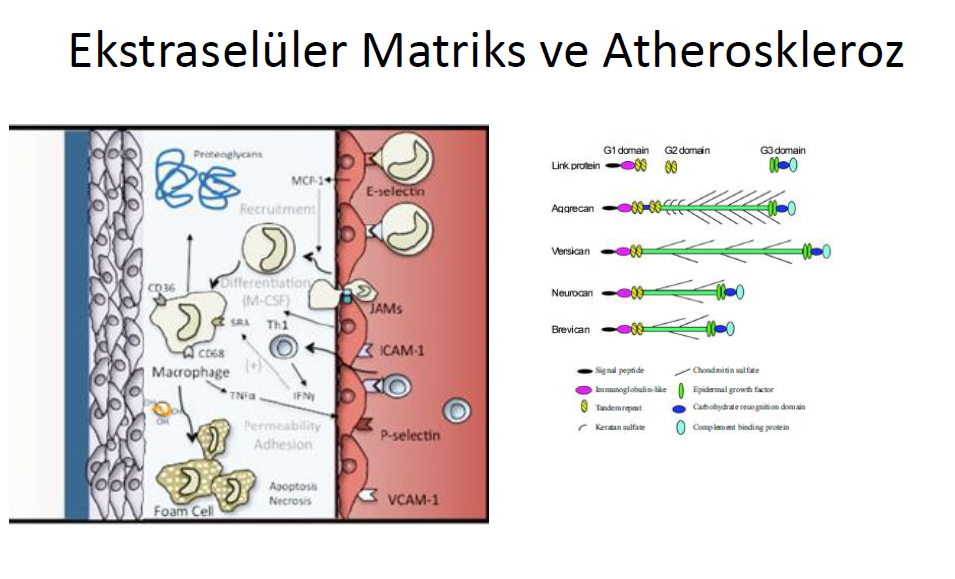
Atheroskleroz ve koroner arter hastalığında genetik önemli bir rol oynayacaktır. Kollajen IV (COL4A1/COL4A2), integrin subunit beta 5 (ITGB5) ve fibronectin (FN1) gibi ESM ve bazal memebran gen lokasyon mutastonları atheroskleroz gelişmesinde etkilidir. Özellikle bazal membran proteinlerindeki değişiklikler koroner arter hastalığı gelişmesinde önemli hücresel olaylara sebep olur. Yine matriks metalloproteinazları etkileyen gen mutasyonları damar sertliği ve atherosklerotik lezyon progresyonu ile ilgili görülmüştür. Birikimeye-yanıt hipotezine göre, kollesterol içeren lipoprotein partiküllerinin intimal proteoglikanlara bağlanması, atherogenezdeki patojenik gelişimin merkezinde yer alır. Birikme olunca lipoproteinler okside olurlar ‘köpük hücreleri’ içinde toplanır ve inflamasyon süreç kaskadını tetikleyerek atheroskleroz sürecinin devamını ve sonunda plak rüptürünün gelişmesine zemin hazırlarlar. Atherosklerozun erken evresinde normal arterlerdeki en büyük temel çökertici proteoglikan olan versikan, lipoprotein birikimine sebep olur. Versikan yaşlanmaya, hipertansiyona ve zedelenmeye bağlı birikebilir. Versikanı veya onun glycosaminoglycan yapısını etkileyen proatherojenik uyarı, plak gelişimine etkili olabilir. Yine lipoprotein birikiminde biglikanın etkili olduğuda söylenmiştir. Arter duvarındaki versikan temel hyaluroran bağlayıcı proteoglikandır. Domuz modellerrinde ise stent yerleştirilmesi sonrası agrekan ekspresyonu artar.Stenozun tersine agrekanın dilatasyon ve tortiyoz görünümlü insan variköz venlerinde arttığı gösterilmiştir.
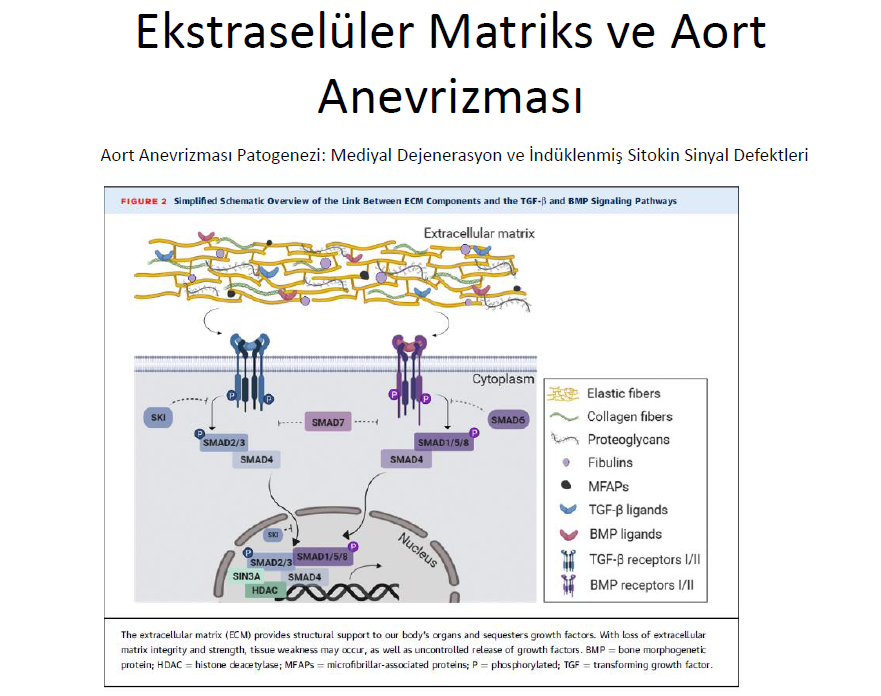
Aort anevrizması aort duvar zayıflığına ikincil gelişen ilerleyici genişleme veya şişkinliktir. Diafragma altında olan abdominal aort anevrizmaları torasik olanlardan çok daha sık görülür. Torasik aort anevrizması daha genç popülasyonda görüldüğü ve herediter olması sebebi ile daha fazla incelenmiştir. Torasik anevrizam vakalarının % 20-25 inde aile hikayesi mevcuttur ve mevcut sekans teknolojileri sayesinde yaklaşık 1/3 hastada monogenik sebep tespit edilmiştir. Mendelian geçişli bağ doku hastalıkları (otozomal dominant veya ressesif) torasik aort anevrizma patogenezini araştırırken tanı şemasında önemli bir yerde olmalıdır. Torasik aortik anevrizmalarında elastik fiber parçalanması, kolajen fibril disorganizasyonu, proteoglikan birikimi , vasküler düz adele hücre kaybı ve kontaktilden sentez fazına geçiş ile ortaya çıkan aortik lezyon histopatolojik olarak medial (cystic) dejenerasyon olarak karakterize edilmiştir. Torasik aort anevrizma gelişiminde vasküler düz kas hücreleri protoagonist olarak kabul edilir. Bu hücreler daha az kontraktil ve apoptoza yatkın oluşları ile ESM in medial dejenerasyona sebep olmasına katkı verirler. Normal aortalarda vasküler düz adele hücreleri matriks metalloproteinaz salınımı ve doku inhibisyonu ile ESM hemostazını sıkı olarak kontrol altında tutarlar. Torasik aort anevrizmasında matriks metalloproteinazların aşırı ve uygunsuz sentezi ESM dejenerasyonuna sebep olur. Bu şekilde belirgin halde ESM in yapısı bozulurve ESM hemostazını düzenleyen sinyal döngüleri (transforming growth factor [TGF]-b sinyali veya bone morphogenetic protein [BMP] sinyali) ile ilgili ve biyoyararlılıkları bozularak ESM çökeltisi ile daha da belirginleşen sitokinlerin salınmasına neden olur. Bu patolojik olayların tamamı aortik duvar zayıflamasına sonucunda da pulsatil kan akımı ve kan basınca bağlı dayanma kuvvetinin azalmasına neden olur.


Bazı kollajen gen defektleri (örneğin, COL1A1, COL1A2, COL3A1, ve COL5A1) aort anevrizması ile ilişkili bulunmuştur. Otozomal dominant bağ doku hastalığı olan ve deri saydamlığı, çabuk morluklar oluşması, arter ve iç organ kırılganlığı ile seyreden vasküler Ehlers-Danlos syndromuda (vEDS) % 95 oranında COL3A1 mutasyonlarına rastlanmıştır. Bu arteriyel anevrizma ve veya rüptür, gastrointestinal perforasyonlar ve küçük eklem gevşekliği ile seyreden hayatı tehdit eden komplikasyonları olabilen bir hastalıktır. Klasik Ehlers-Danlos sendromu eklem hiperekstensibiltesi ve atropik skarlar ile seyreder bunlardaki COL5A1 mutasyonu varken bu mutasyon nadiren vEDS da vardır . COL1A1 ve COL1A2 mutasyonları; multiple kırıklar, iskelet deformitesi ve/veya kısa boy, dentinogenezis imperfekta, duyma kaybı ve mavi sklera ile seyreden osteogenesis imperfecta denilen bağ doku hastalığına neden olur. Aort anevrizma disseksiyonları COL1A1 veya COL1A2 mutasyonu olan osteogenesis imperfecta hastalarının %10- %30 ında görülür.

Elastin kodlayan genlerde dominant şekilde olan negatif mutasyonlar elastikiyetini kaybetmiş sarkık deri ile karakterize otozomal dominant seyirli cutis laxa (ODKL) ya sebep olur. Elastin kodlayan gen kesi mutasyonları ise supravalvüler aortik stenoza sebep olur. Otozomal dominant seyirli cutis laxa hastalarının %30 -%50 sinde torasik aort anevrizması görülür. Otozomal dominant seyirli cutis laxa’da elastin kodlayan genlere bağlı aortopathy aile içinde, hafif dilatasyondan aort rüptürü ne kadar gidebilen farklı klinik seyirlerde görülebilir.Elastin kodlayan genin üç farklı şekilde etkilenmesi torasik anevrizmasından etkilenen ailelerde farklı kliniklere sebep olmakta.
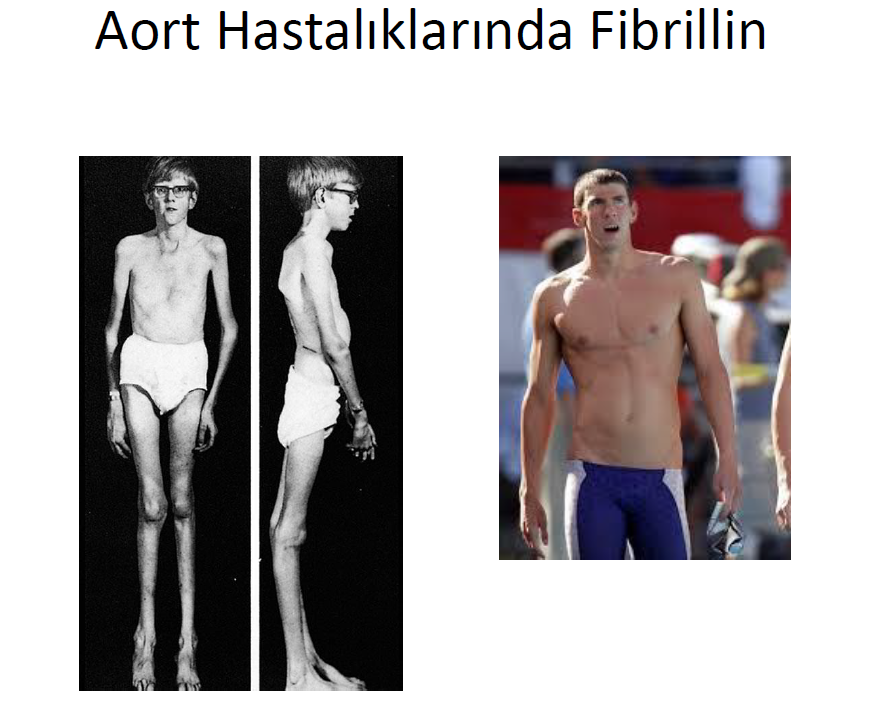
Sisteinden zengin glikoproteinlerden olan fibrillin-1 (FBN1) ve fibrillin-2 (FBN2) , elastik fiberlerin major kompanenti olan mikrofibril çatısının temel taşlarıdır. FBN1 ve FBN2 genlerinde meydana gelen dominant mutasyonlar konjenital kontraktüral arakynodaktili ile seyreden Marfan sendromuna sebep olur. Marfan sendromu iskelet (kemik aşırı büyümesi, eklem gevşekliği), oküler (ektopia lentis), deri (striae) ve kardiyovasküler belirtiler ile aort anevrizması ve hayatı tehdit eden aort diseksiyonları ile seyrede bilen plietropik çoklu sistem hastalığıdır. İlerleyici aortopati için FBN2 mutasyonu sonucu exon 32 atlanması anevrizma için yüksek risk kabul edilir ve daha sık kardiyovasküler görüntüleme önerilir.
Diğer Matriks Proteinleri ve Aort Anevrizması
Proteoglikan, fibulin ve mikrofibrill (MFAP) ilişkili proteinlerde torasik aort anevrizmasına sebep olan mutasyonlara rastlanmıştır.Torasik aort anevrizması medial dejenerasyon lezyonlarında, vasküler düz adele hücreleri boşluklarında aggrekan ve versikan birikerek intraIameller şişme basıncında artma, hücre ESM etkileşmesinde bozulma ve aort duvarı mikroyapısında bozulmaya yol açar.Bu masif tortu aggrekan ve versikan mRNA ekspresyonu ve thrombospondin motifli disintegrin ve metalloproteinaz ailesi proteazları tarafından yapılan proteoglikan proteolizinde azalma sonucu oluşur. Bugün için torasik aort anevrizması ile sadece proteoglikanlardan bigliykanı kodlayan X bağımlı BGN gen mutasyonunun ilişkisi gösterile bilmiştir. BGN gen mutasyonu Meester-Loeys sendromuna sebep olur (hipertelorizim, pektus deformitesi, eklem hipermobilitesi, kontraktürler ve hafif iskelet displazisi ile karakterize ciddi torasik aort anevrizması). Fibulinler elastik fibriller ve bazal memranla ilişkili yüksek oranda korunmuş evrimsel ESM proteinleridir.Elastogenezde rol alan bugüne kadar bilinen fibulinler arasında, fibulin-4 ve fibulin-5 en kritik ve gerekli olanıdır. Spesifik olarak fibulinler tropoelastin multimerizasyonunu potansiyele eder ve etkinliğini artırır, elastin çapraz bağlarını kolaylaştırır ve mikrofibrillerde elastin birikimine yardımcı olur. İlgili genlerde resesif mutasyon ( örneğin FBLN4 ve FBLN5) cutis laxa sendromlarına sebep olur.FBLN5 mutasyon taşıyıcıları akciğer amfizemi ile seyrederken, FBLN4 mutasyonları aortik veya arteriyel anevrizma ve tortiozite ile seyreder. Buna dayanarak araştırıcılar fibulin-4 ün damar duvarında kollajen bütünlüğünün korunmasında gerekli, fibulin-5 in ise gereksiz olduğunu öne sürmüşlerdir. Son olarak da mikrofibrillar associated protein 5 (MFAP5) in mutasyona bağlı fonksiyon kayıplarının torasik aort anevrizmasına yol açtığı ileri sürülmüştür. 5 (MFAP5) delinme fenotipi pek az ailede tanımlanmıştır. Sendromik gibi gözükmemektedir.Elastin ve kollajen çapraz bağları sıkı kontrollü enzimatik işlemlerle düzenlenir.Procollagen-lysine 2-oxoglutarate 5- dioxygenase (PLOD) enzimleri kollajen salınımından önce lyzin hidroksilasyonunu katalize eder. Lyzil oxidazlar kollajen salınımında, hidroksil lyzin rezidülerinin adelitlerine çevirilmesinde bakır enzimleri rol alır.Her iki enzim mutasyonlarıda torasik aort anevrizması gelişimi ile ilişkilendirilmiştir. PLOD1 bialellik mutasyonu, hipotpni, erken ortaya çıkan kifoskolyoz, genel eklem hipermobilitesi, deri frajilitesi ve göz bulguları ile karakterize kifoskolyatik Ehlers Danlos sendromuna sebep olur. PLOD1 defektli hastalarda aorta da ve orta boy arterlerde anevrizma ve diseksiyonlar oluşabilir.LOX aortada ki lyzil oksidazın çoğunu kodlar, heterojen mutasyonları katalitik aktivitesini bozarak veya haplo yetmezliğe sebep olarak diğer bağ doku belirtileri ile birlikte torasik aort anevrizmasına sebep olabilir.
Transform Edici Growthfactor-b Sinyalizasyonu Bozukluğuna Bağlı Aort Anevrizması
Patolojik TGF-b sinyalizasyonu artışı ile torasik aort anevrizma oluşması ilk olarak Marfan sendromunda gösterilmiştir.Normal fizyolojide fibrillin-1 içeren mikrofibriller TGF-b ligantları ile ESM hedeflerini sıkı şekilde kontrol eder.FBN1 mutasyonları mikrofibriler haber ağının zayıflamasına ve TGF-b nın sınırsız salınım ve yıkımının azalmasına sebep olur. İlginç olarak ESM diğer komponentlerini (ör BNG ve FBLN4) kodlayan gen mutasyonlu torasik aorta anevrizma hastalarında, aort duvarlarında TGF-b sinyalizasyon artışı tespit edilmiştir. Torasik aort anevrizmalarında TGF-b düzenleme bozukluklarının rolü, Marfan sendromu ile belirgin fenotip örtüşümü olan Loeys-Dietz sendromlu hastalarda TGF-b reseptör (TGFBR1 ve TGFRB2, ligantlar (TGFB2 ve TGFB3) ve baskılayıcı effektör (SMAD2 ve SMAD3) fonksiyon kaybı mutasyonları şeklinde gösterilmiştir. TGF-b döngüsünde negatif düzenleyici SKI daki mutasyonlar benzer bir torasik aorta sendromu olan Shprintzen- -Goldberg sendromunda gösterilmiştir. Juvenile polyposis sendromu ve/veya herediter hemorrajik telanjektazi de SMAD4 gen dominant mutasyonların torasik aort anevrizması ile ilişkisi gösterilmiştir.
Kemik Morfogenetik Protein (KMP) Sinyalizasyonu ve Anevrizma Oluşumu
TGF-b ligantlarına benzer şekilde,mikrofibril ile ESM çökertilmesinin düzenlenmesinde kemik morfojenik KMP sitokinlerinin görev aldığı ileri sürülmüştür. Biküspit aortik kapak ile ilişkili torasik aort anevrizmalarında KMP sinyalizasyon inhibitörü SMAD6 ın fonksiyonunu kaybettiren mutasyonlar tespit edilmiştir. SMAD4 mutasyon taşıyıcılarının yaklaşık % 40 ında torasik aort anevrizması görülmesi yine KMP sinyalizasyonu ilişkisini düşündürmüştür.
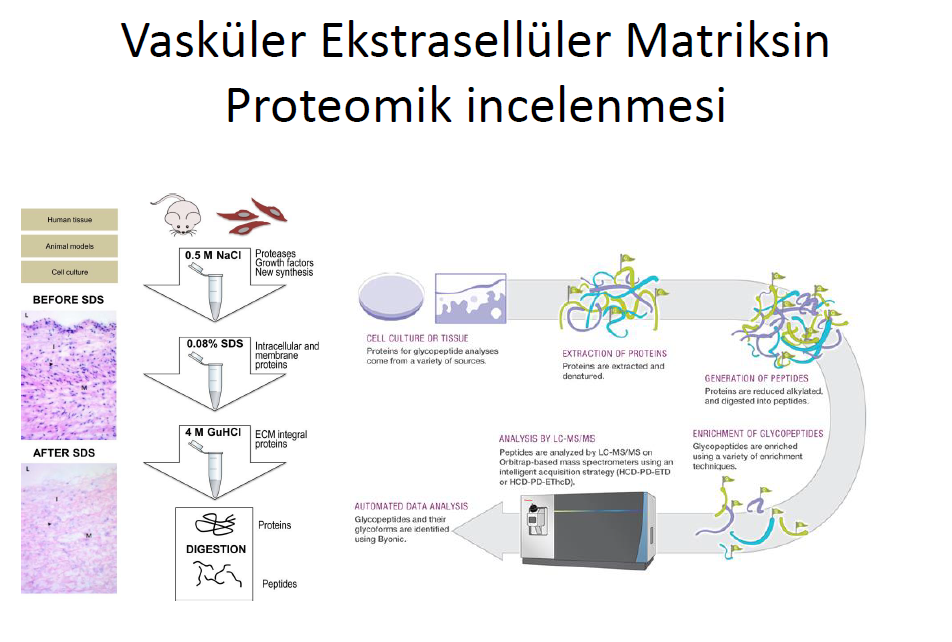
Ekstrasellüler proteinler proteomik incelemeler ile değerlendirilmektedir.Bu metodun temeli deselülerizasyona dayanır.Özgün proteazlar ile ESM ürünleri çökertilerek yeni proteaz hedefleri tanımlanır, vasküler düz kas ve endotel hücrelerinden salınan proteinler analiz edilirler. Günümüzde son glikoproteomik teknolojiler vasküler hastalıklarda ESM proteinlerini glikolytik değişiklikler ile tespit edebiliyor. Marfan sendromlu anevrizma hastaların glikoproteomik çalışmalarında MFAP4 artışı ile birlikte diğer anevrizma hastalarından farklı N-glikolizasyon paternleri tespit edile biliyor. Örneğin Marfanda artmış plazma MFAP4 miktarı ile B- tipi aort diseksiyon sıklığı arttığı bulunmuş.
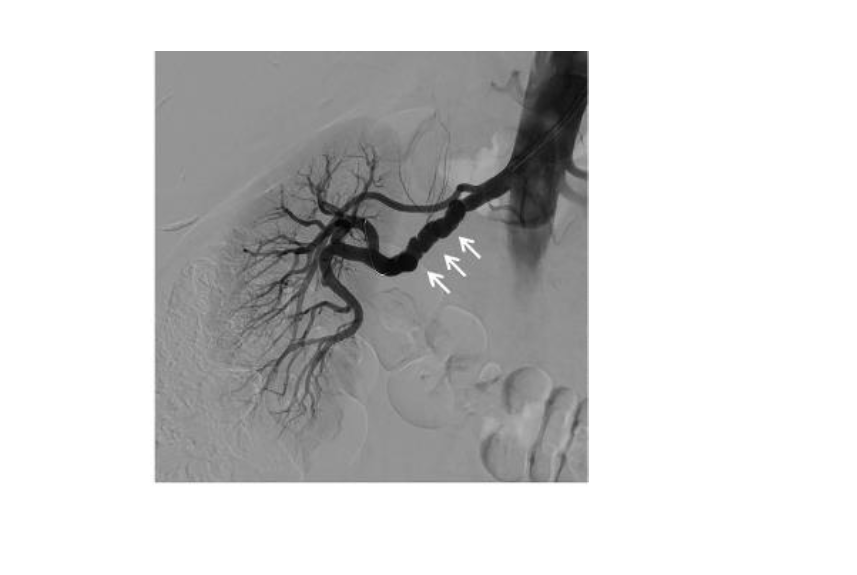
Her zaman hastalıkları açıklamakta başarı sağlanamamış. Örneğin orta yaş kadınlarıda orta ve geniş çaplı arterleri etkileyen , spontan koroner arter diseksiyonu ile ilişkili olduğu düşünülen fibromüsküler displazi hastalığında, ESM içeriğinde belirgin değişiklik görülmekle birlikte genetik ve patolojik değişiklikler tanımlanmamıştır.Şekilde mutifokal fibromusküler displazide dizilmiş boncuk görünümünde renal arter izlenmekte.

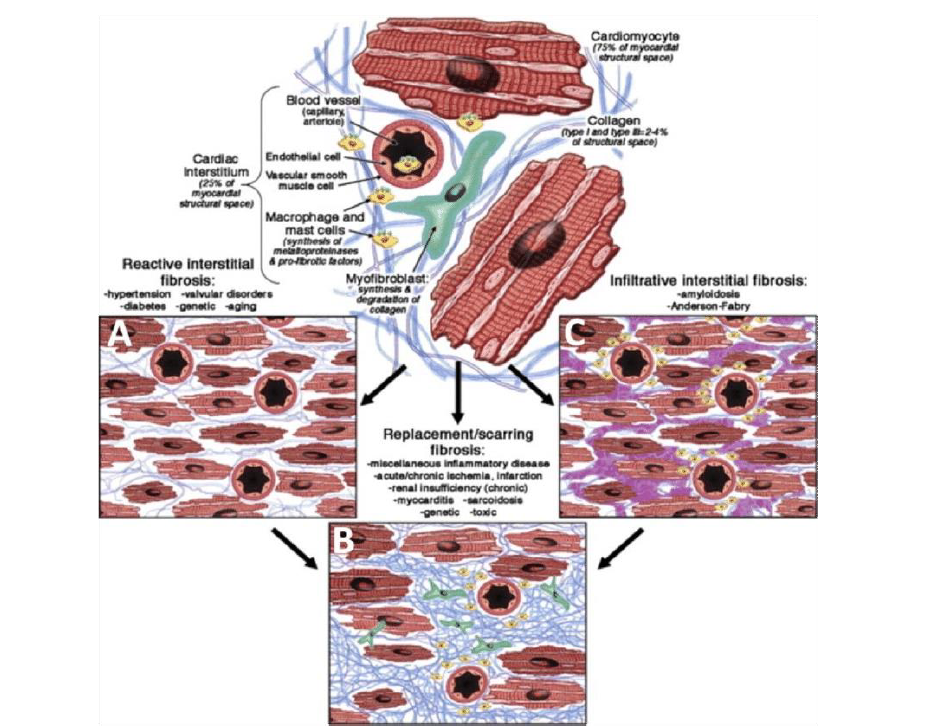
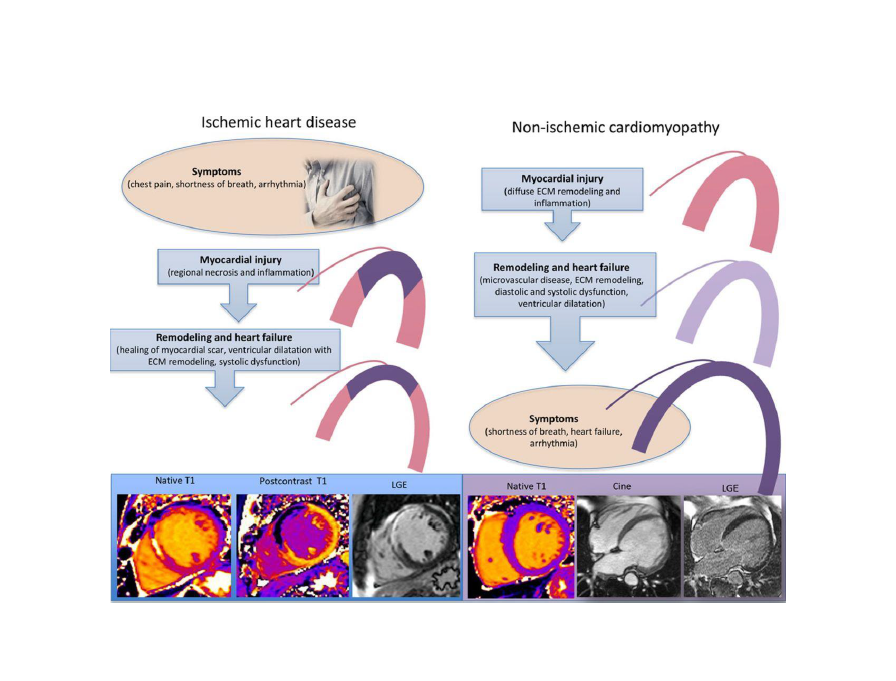
Miyokardiyal interstitium, stromal hücreler, yapısal proteinler (kollajen, elastin) , protein-şeker kompozitleri (glikoprotein ve proteoglikanlar), glikosaminoglikanlar (hyaluronan) ve biyoaktif sinyal molekül reservaruandan oluşan destek görevli karmaşık ESM den oluşan kardiyak doku kompartmanıdır. ESM pasif değil aksine yapısal bütünlüğü koruyan, kalp siklusu sırasında kuvveti ileten , hücreler arasında iletişimi sağlayan ve kardiyak zedelenme sonrası onarım yanıtını oluşturan, ileri derecede organize kompleks ve dinamik bir mikroortamdır. Ancak iskemik ve noniskemik zedelenmeler sonrasında kalp üzerine etkili olan biyomekanik stress, kardiyak ESM ve diğer yapılarda değişiklik yaparak, miyokart yapısının mimarisini (remodeling) etkileyerek kardiyak fonksiyon değişikliklerine ve kalp yetersizliği ne sebep olur. Genel görüş kalp yetersizliğinde ESM deki ana değişimin, miktar, kalite ve organizasyon yönünden kollajen ağını etkileyen kollajen döngüsü üzerinden olduğu şeklindedir ( Kollejen tip I ve III fiberleri üretim, birikimi ve yıkım, temizleme döngüsü).Örneğin kollajen fibrilleri üretim ve birikimi, yıkım ve temizlemeye oranla baskın ise lokal (infarkt sonrası) veya diffüz (interstisyel) miyokardial fibrozise sebep olur.Tam tersi kollajen yıkım ve temizlenmesi, üretim ve depolamaya oranla daha baskın olur ise perimysium ve endomysiumda fizyolojik kollajen iskeletinde kesintiler ve kayıplar ortaya çıkar.
Noniskemik kardiyak hastalıklar olarak adlandırılan hipertansiyon, aort darlığı,diyabetik kardiyomiyopati ve hipertrofik kardiyomiyopati de ventriküler ESM değişikliği miyokardiyal interstisyel fibrozis (MIF) şeklinde olur. MIF, miyokardiyal interstisyel mimariyi bozan ve kollajene özgül boyama yöntemleri ile incelenen miyokart örneklerinde niceliksel olarak yüzdesel miyokart dokusunu fazlaca işgal eden kollajen birikimi ile karakterize durumdur.
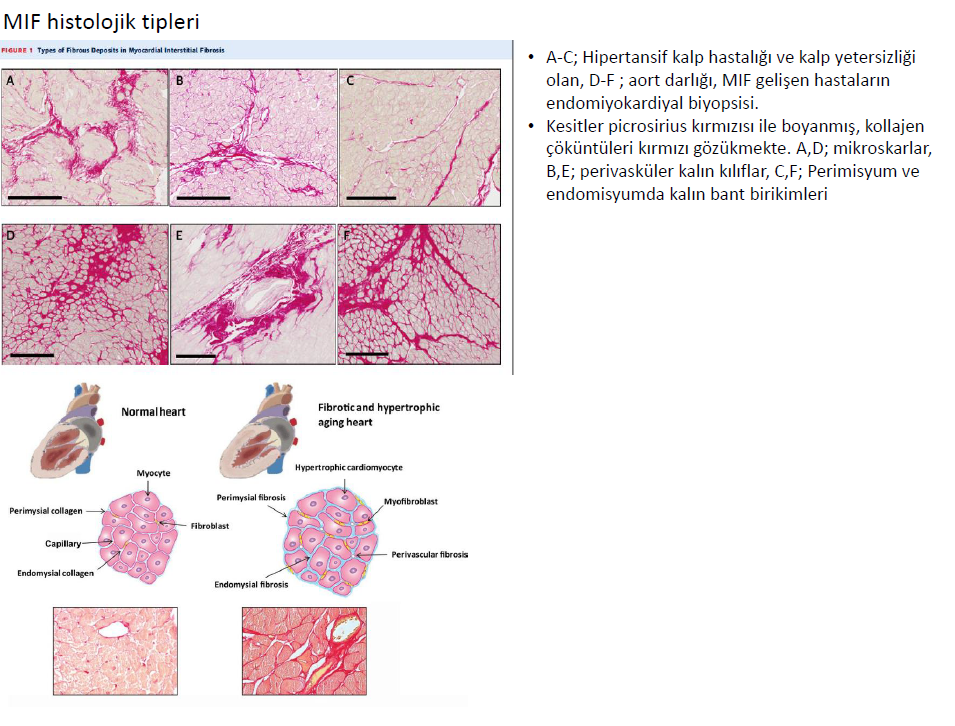
Tekrarlayan MIF sonrasında tipik olarak fazla kollajenin çökelmesi ile mikroskarlar görülür. Farklı olarak reaktif MIF de, perivasküler alanda intramural koroner arterler ve arteriollerin etrafında veya kardiyak adaleleri paket gibi sarmalayan perimisyumda ve her bir kardiyomiyosit etrafı endomisyumda kalın fibrotik kılıflar şeklinde kollajen çökertileri görülür. Bu iki farklı histolojik tür MIF farklı durummudur, yoksa hastalık gelişim sürecimidir, çok net olarak saptanamamıştır (Çoğunlukla aynı hastada iki durumda görüle bilir). Örneğin hipertrofik kardiyomiyopatide erken evrelerde perivascular, perimysial, ve endomysial çökeltier baskın olarak bulunmakta ve hastalık ilerledikçe fibrozis baskın hale gelerek skarlar oluşmaktadır. MIF adacıklar halinde tarif edilmekle birlikte hipertansif, aort darlıklı ve hipertrofik kardiyomiyopatili hastalarda, fibröz çökeltilerin yayılımı ventrikül serbest duvarı dış 1/3ünden iç 1/3 üne doğru ilerler.
MIF Bileşen ve Organizasyonu
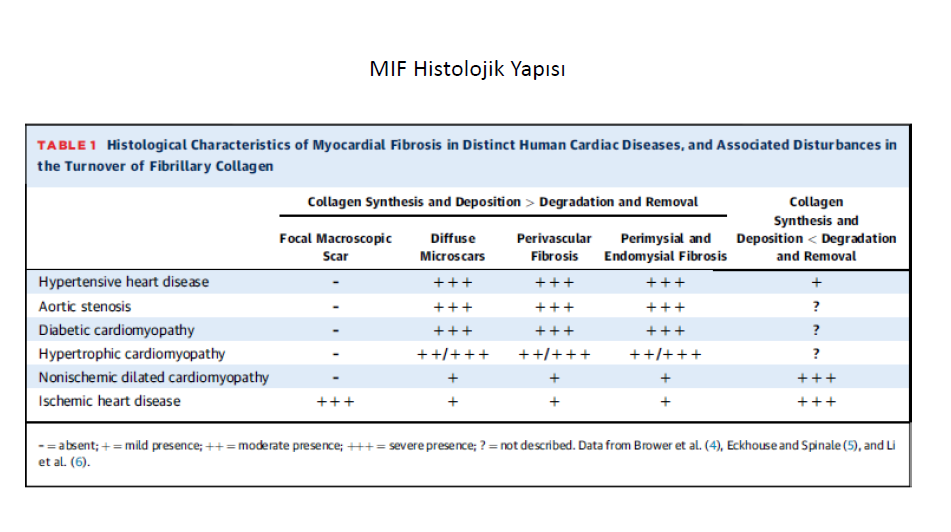
Son verilere göre MIF ile fibröz birikmeler ve kollajen fiberlerin yapısal ve fizyokimyasal özellikleri ilişkilidir. Örneğin hipertansiyon ve aort darlığına bağlı kalp yetersizliğinde kollajen tipI /tip III, tip I lehine belirgin artmakta iken diyabetik kardiyomiyopatide tip III, tip I e oranla belirgin olarak artar, hipertrofik kardiyomiyopatilerde ise kollajen tipleri üzerinde bir farklılık yoktur. Kollajen fiberlerinin çözünmeye, çökmeye karşı direnci ve sertliği temel fibriller arasındaki intermoleküler kovalan bağların (çapraz bağlar) düzeyi ile ilişkilidir. Kollajen çapraz bağlanımında ana mekanizma, lysl oksidaz (LOX) ailesindeki enzimlerin lysl hidroksilaz ve transgulutamin ailesi ile uyum içinde çalışarak özgül kollajen lyzinlerini oksitlemesi şeklindedir. İkinci bir tip kollajen çapraz bağlanması, ileri glikasyon son ürünleri (AGE) ile lyzin artıklarının glikasyonu ile olur. LOX un miyokartda baskın halde tespit edilmesi normal ejeksiyonlu kalp yetersizliğinde ve aort darlığında bildirilirken AGE birikimi diyabetik kardiyomiyopatilerde bildirilmiştir. Kollajen çapraz bağlarında artışın (çözünmeyen ile çözünen kollajen oranında artış ile ölçülür) LOX aktivitesinde artış ile birlikte görülmesi ejeksiyon fraksiyonu normal kalp yetersizliği (hipertansif kalp yetmezliği) ve aort darlığında bildirilmiştir.
MIF Histomoleküler Heterojenitesi
Yapılan bir çalışmada kollajen birikimi miktarı ve çapraz bağ derecesi hipertansif kalp yetmezlik hastalarında farklı MIF fenotiplerinin histomoleküler heterojenite ile ilişkisini bize gösterdi. Bu çalışmada dört tip hasta belirlendi ; Orta derecede birikim ve normal çapraz bağ; ciddi derecede birikim ve normal çapraz bağ; orta derecede birikim ve artmış çapraz bağ; ciddi derecede birikim ve artmış çapraz bağ. Bu gurupların birincisinden sonuncusuna doğru, pulmoner kapiller köşe basıncı, pro-BNP düzeyi, kalp yetersizliği ile ilk hastaneye yatış ve kardiyovasküler ölüm istatistiksel olarak belirgin artış gösterdi. En fazla risk ciddi derece birikim ve artmış çapraz bağ gurubunda idi. Diğer noniskemik MIF lerde bu kural işliyormu diye araştırmalar yapmak lazım.
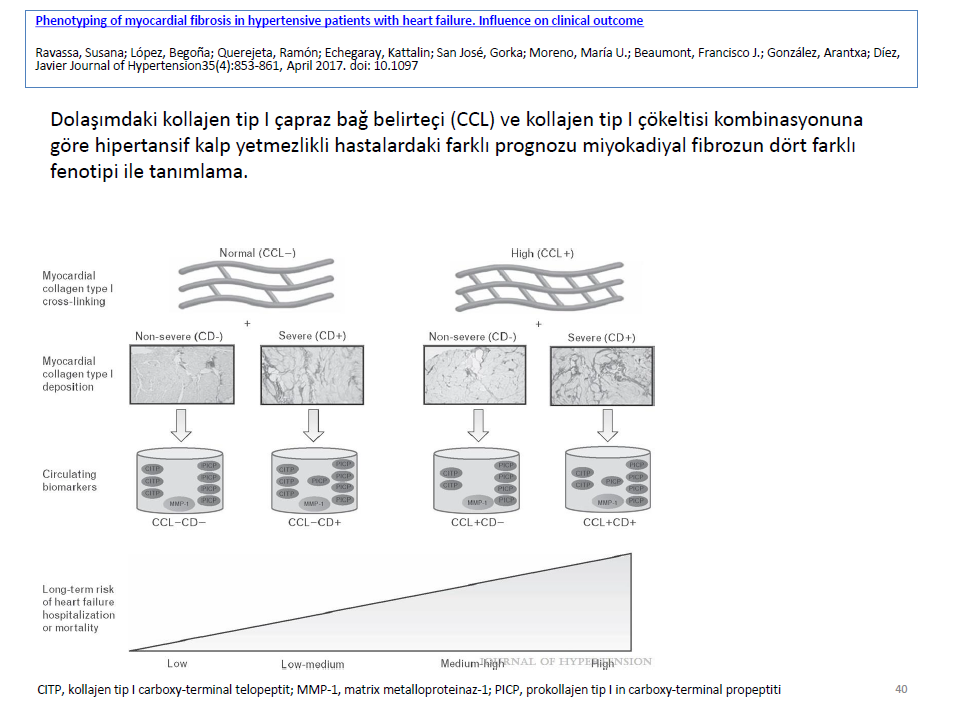
Dolaşımdaki kollajen tip I çapraz bağ belirteçi (CCL) ve kollajen tip I çökeltisi kombinasyonuna göre hipertansif kalp yetmezlikli hastalardaki farklı prognozu miyokadiyal fibrozun dört farklı fenotipi tanımlanmıştır. Hipertansif kalp yetersizlikli hastalarda kollajen tip I karboksi-terminal telopeptitin matriks metalloproteinaz-1 e oranı 1.968 veya altı olması yüksek miyokardiyal kollajen tip I çapraz bağı olarak kabul edilir ve prokollajen karboksi-terminal propeptit serum seviyesi en az 110.8 ng/ml olması ciddi miyokardiyal kollajen birikimi ile ilişkili kabul edilmiştir. Bu bulguların ötesinde dolaşımda bulunan iki biyobelirteçin kombinasyonu miyokardiyal fibrozis ile ilişkili kalp yetersizliği ile hastaneye yatış ve mortalite açısından hastaların dört farklı fenotipe ayrılmalarını sağlamıştır. CCL+CD+ fenotipi kalp yetersizliği ile hastaneye yatış veya kardiyovasküler ölüm ve tüm sebeplerden dolayı ölüm açısından en riskli guruptur.

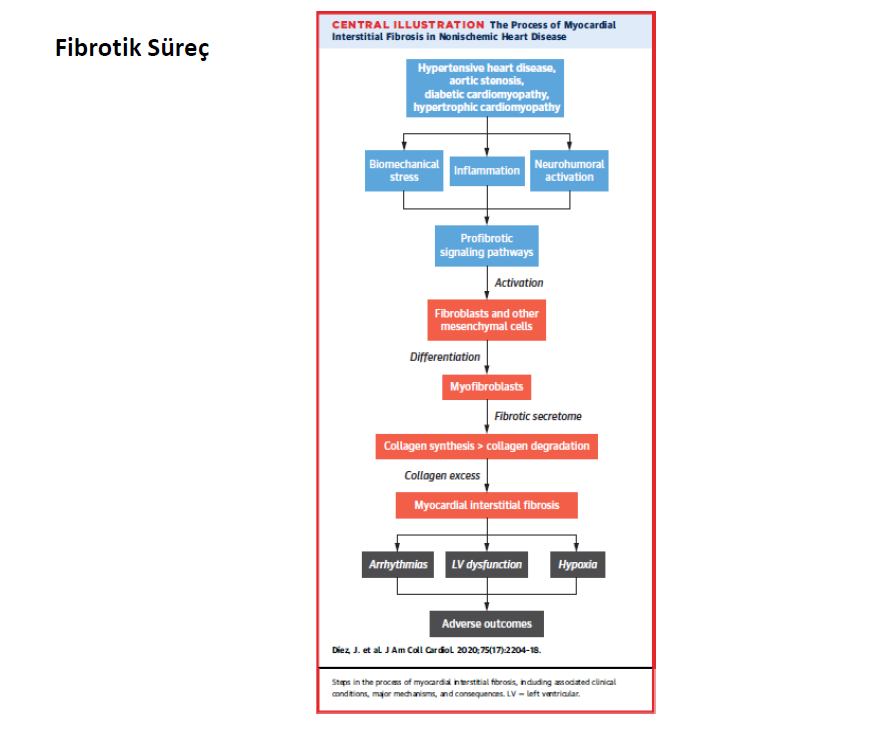
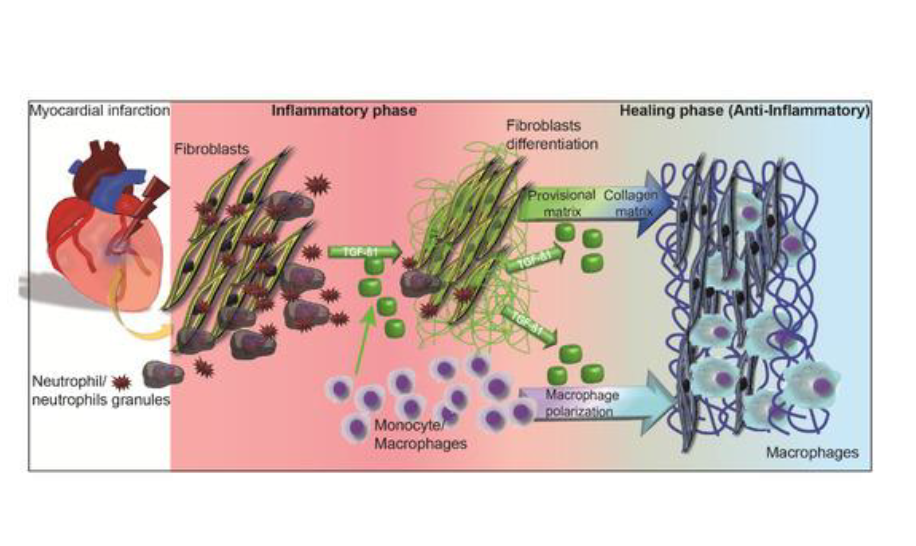
Tekrarlayan MIF i sıklıkla tetikleyen olay kardiyomiyosit ölümüdür.Dokudaki zedelenme sonucunda lokal immün hücrelerin ( temelde makrofaj) aktive olması ve zedelenme alanına istenmeyen kan hücrelerinin girmesi inflamatuar bir yanıt oluşturur. Lokal ve işgalci hücreler çok sayıda aktif çözünen mediatör (sitokin, kemokin gibi) üreterek , fibriller kollajen ve diğer ESM molekülü üretme yeteneğine sahip ve ayrıca proinflamatuar sitokinleri, kemokinleri, büyüme faktörlerini daha da artıran mezenkimal hücreleri (fibroblast) lokal olarak aktive ederler. Reaktif MIF de hücre ölümü olmaksızın farklı uyarılar fibrozisi tetikliyebilir, örneğin hipertansiyon ve aort darlığında basınç yüklenmesine bağlı mekanik stress, hipertrofik kardiyomiyopatide sarokmer yapı ve fonksiyonunda farklı mutasyon ile oluşan defektler, diyabetik kardiyomiyopatide veya korunmuş ejeksiyon fraksiyonlu hastalarda koroner mikrovasküler endotelial inflamasyon ile ilişkili metabolik zedelenme, mezenkimal hücrelerde farklı fibrotik sinyal yolaklarını uyararak fibrozise sebep olur.
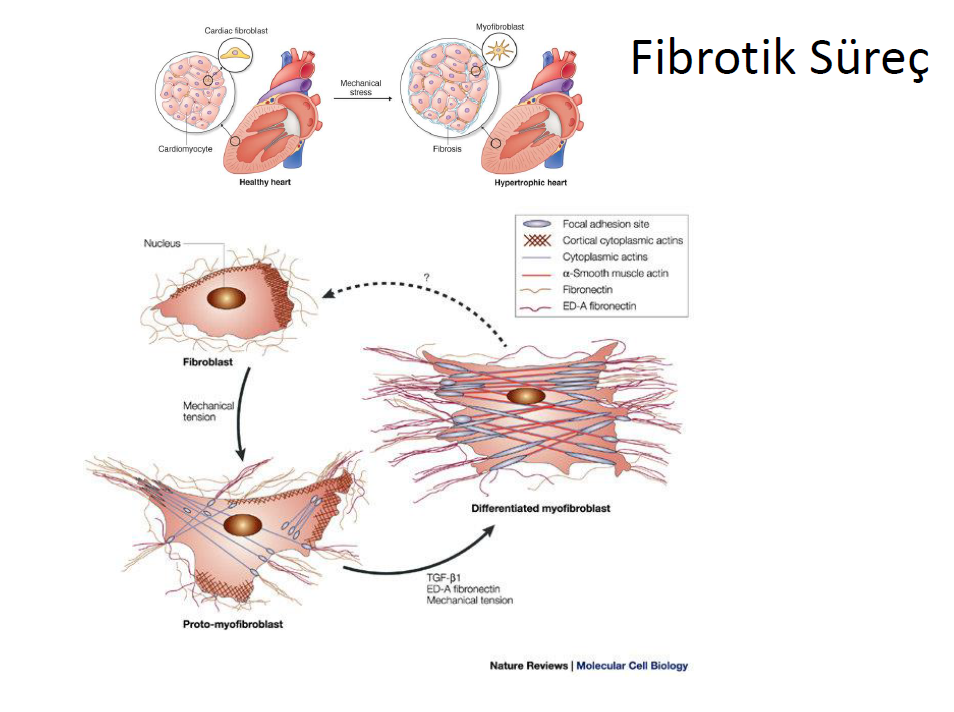
Kardiyak fibroblastlar , zedelenme sonunda artan farklı zedelenme bağlantılı mollekül paternlerini tanıyan geniş bir immünite yolağı başlatım tanıyıcı reseptör yelpazesi içerirler. Ölen hücreler tarafından salınan moleküllerler (heat şok proteinleri), proinflamatuar sitokinler (interlökin 1a), zedelenmeye bağlı salınımı artırılan ESM molekülleri (fibronektin) veya patolojik ortamda değişime uğrayan moleküller zedelenme bağlantılı molekül paternlerini oluşturur. Aktive olan fibroblastlar sekresyon yapan fenotipe çoğalıp evrilerek, yapısal ve fenotipik olarak düz kas hücresine benzer kontraktil stress fibrilleri ve yeni oluşan bir düz adele aktini ve yaygın endoplasmik retikulum içeren miyofibroblasta dönüşürler. Kardiyak fibroblastlar, çok sayıda nörohumoral faktörler, sitokinler ve büyüme faktörleri için sinyal yolaklarını düzenleyen reseptörler içerir. İyon transport yolaklarını düzenleyen geniş bir iyon kanal yelpazesi vardır. Kardiyak fibroblastlarda integrinsand discoidin domain reseptörü denilen mekanik duyu ile ESM ile etkileşen, miyofibroblastlara dönüşümü, hücre göçünü ve proliferasyonu uyaran hücre yüzey reseptörleri vardır.
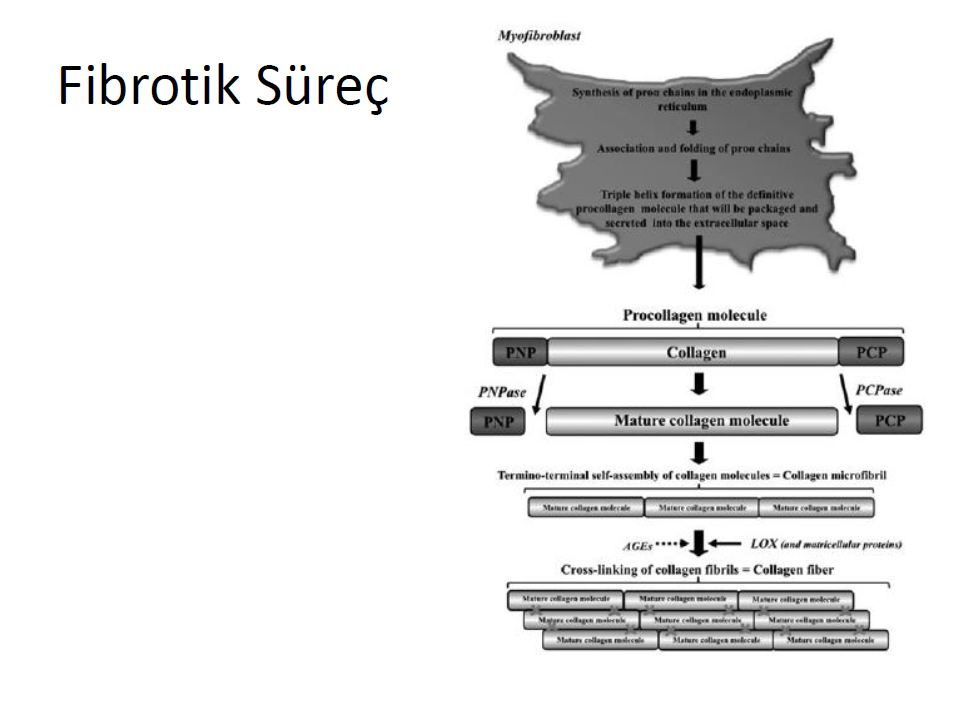
Miyofibroblastların profibrotik salgısı, ekstraselüler fibriler kollajen döngüsünü değiştirir ve MIF i başlatır, ayrıca zedelenen miyokartda, otokrin ve parakrine faktörler salınımına sebep olarak hücre çoğalmasını ve metabolik aktiviteyi artırır, fibrogeneze sebep olur. Miyofibroblastlar tarafından tip ve tip III prokollajen öncülleri ve kollajen tip I ve III fibrillerin sentezi, çökelmesi ve parçalanması ile ilişkili enzimler salınır. Prokollajen tip I amino-terminal proteinaz (diğer adı ile thrombospondin motifleri 2 disintegrin ve metalloproteinaz [ADAMTS2]) ve prokollajen tip I karboxy-terminal proteinaz veya PCP (bonemorphogenetic protein-1 diye bilinen) enzimler miyofibril tarafından salınan prokollajen perküsör terminal propeptitlerini bölerek olgunlaşmış fibrilere çevirerek kollajen molekülünü oluşturur. Takiben LOX ailesi enzimleri, ardışık fibriller arasında polipeptit zincirlerin bağlanmasını katalize eder (çapraz bağ) ve miyokardiyum da biriken son ürün kollajen tipi fibrili oluşturur. Diğer taraftan matriks metalloproteinaz (MMP)1 enzimi fiberler içindeki kollajen moleküllerinin parçalanmasına sebep olarak kana salınan küçük karboksi-terminal telopeptidt ve parçalanma süreci devam eden büyük sonradan matrikinler denilen MMP2 ve MMP9 olmak üzere iki peptide bölünen molekülleri oluştururlar. MIF durumunda fibrojenik PCP/LOX aksı, fibrolytitik MMP-ile uyarılan aksa göre daha baskındır.
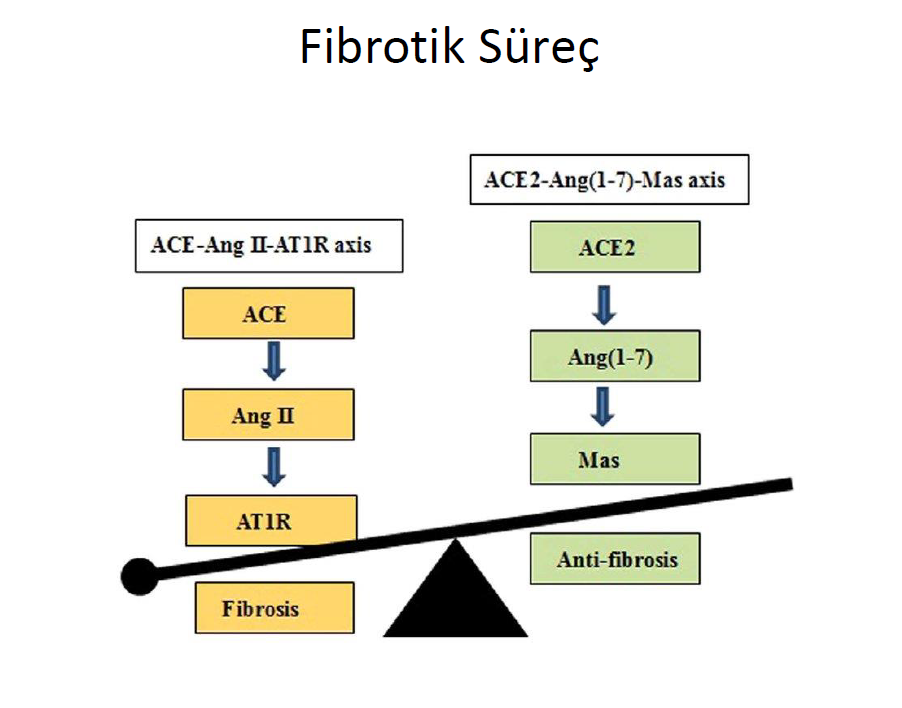
Miyofibroblastların lokal pro-fibrotik etkisinde anjiyotensin sistemi etkilidir. Anjiyotensin converting enzim (ACE)/anjiyotensin II/ anjiyotensin tip 1 reseptörünü içeren fibrojenik aks, miyofibroblastdan tip I ve tip III prokollajen salınmasını artıran en önemli sinyal sistemlerinden biridir. Bu aks transforme edici büyüme faktör (TGF)-b/Smad yolağının baskılanması aracılığı ile ve MIF durumunda anjiyotensin II nin ACE2-temelli hidrolizi ile Ang-(1-7) oluşumu yolu ile ters yönde düzenleyici fibrolytik ACE2/anjiyotensin(1-7)/Mas reseptör aksı baskılanması ile etki eder. Ang-(1–7)/Mas reseptör sinyalleri antiapoptotik proteinleri inhibe ederek miyofibroblast apoptozunu sağlarlar.
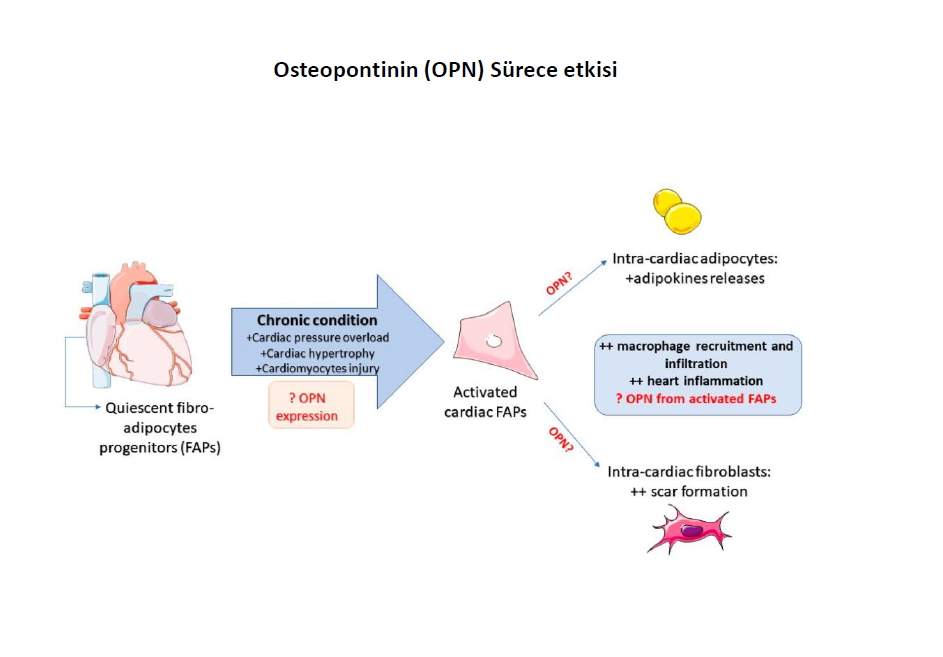
Miyofibroblast, yapısal olmayan matriselüler protein olan osteopontin ve MIF düzenlenmesinde önemli rolü olan yapısal glikoprotein fibronektin gibi ESM makromolekülleri salgılar. Miyokardiyal osteopontinin fazlalığı LOX artışı ile, çözünmeyen kollajen ve tip I kollajen birikmesi ve hipertensif kalp hastalarında sol ventrikül sertliği ve dolum basınç artışı ile ilişkili bulunmuştur. İnsan kardiyak fibroblastlarında osteopontinin LOX ekspresyonunu ve aktivitesini artırması , bu matriselüler proteinin MIF üzerine kollajen parçalanma-sertlik ve sol ventrikül sertliği üzerine LOX-aracılı tip I kollajen çapraz bağlarını kontrol ederek etkili olduğunu düşündürür. Diğer taraftan invitro miyofibroblast patolojik yapısında fibronektin polimerizasyon veya gen ekspresyon inhibisyonu ve invivo basınç yüklenme modellerinde fibrillar kollajen gen ekspresyonu ve kollajen fibril birikmesi gösterilmiştir. Basınç yüklenmesi ile ortaya çıkan MIF da miyofibroblastlar en önemli etken gibi gözükmekle birlikte son araştırmalarda Smad-3 ile tetiklenen yolakla kardiyomiyosit zedelenme ve inflamasyonun engellenmesinde yine miyofibroblastın etkisi olduğu gösterilmiştir. Bu MIF a sebep olan kadriyak interstisyel fibroblastların mikroçevredeki heterojinetiyi değişitrip fenotipik fonksiyonel farklı miyofibroblastlar oluşturabileceğini bizlere gösterir. Fibroblastlar ve miyofibroblastlar dışı farklı hücreler de (örneğin M2 makrofajlar, mast hücreleri, lenfositler, cardiomiyositler ve vasküler hücreler) MIF da görev alır.
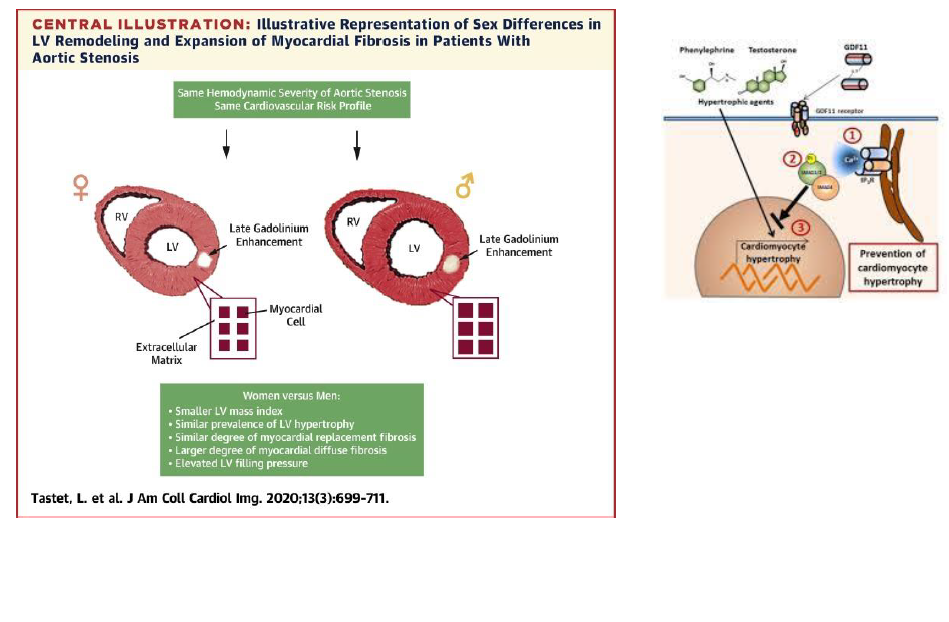
Yaşlılıkta fibrozis çok yönlüdür. Kardiyomiyozit zedelenmesi ile hücre kaybının yerini kaplayan fibrozis görülebilir. Aynı zamanda devam eden fibrozis, oksidatif stresde yaşa bağlı artış ve sonucunda reaktif fibrozis olabilir. Cinse bağlı farklılıklarda vardır, örneğin aort darlıklı erkek hastalarda kollajen tipI ve III yoğunluğu kadın hastalara göre daha belirgindir. Kollajen I ve III ün cinsiyete bağlı düzenlenmesinde ,17b-estradiyol ile farklılaşan kardiyak fibroblast estrojen reseptörlerinin (ERa ve ERb) etkili olduğu düşünülmektedir. Diğer taraftan androjen eksikliğinin kardiyak zedelenme üzerine etkili olduğu gösterilmiştir.

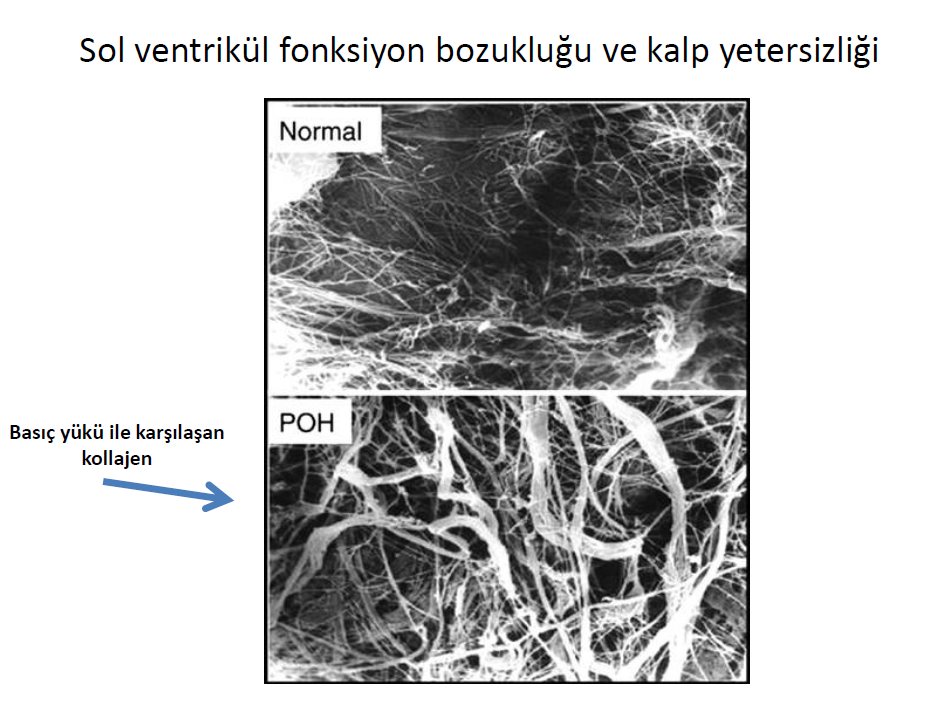
Histolojik veya kardiyak MR ile değerlendirilen MIF, hypertansif kalp hastalarında, aort darlığında, hipertrofik kardiyomiyopati de ve korunmuş EF li kalp yetersizliği hastalarında sol ventrikül sertliği ve diyastolik disfonksiyon ile ilişkili bulunmuştur. İlginç olarak sol ventrikül disfonksiyonunda, artan kollajenin etkisi, kollajen yapısal değişikliği ile birlikte ortaya çıkar. Örneğin hipertansif kalp hastalığı ve aort darlığı olan sol ventrikül sertliği ve diyastolik disfonksiyon olan hastalarda kollajen çapraz bağlarında artış vardır. Ek olarak kollajen tip I fiberleri tip III e oranla daha serttir, aort darlığı ve kalp yetersizliği olan diyastolik fonksiyon bozukluğu hastalarında kollajen tipI, tip III e oranla daha baskın oranda bulunur. Yine idiyopatik dilate kardiyomiyopati hastalarında Tip I: III oranında artış tespit edilir. Ancak dilate kardiyomiyopatide oluşan yeni kollajen, kararlı çapraz bağlar yapmada yetersizdir, muhtemelen bu özellik ventrikül dilatasyonuna katkıda bulunur. Kollajen reorganizasyonu (kardiyomiyosite oranla fiberlerin diziliminde artmış kollajene bağlı değişiklik durumunda) kardiyomiyozitlerde oluşan kuvvetin ventrikül boşluklarına iletimini azaltarak kontraktiliteyi etkiler.
MIF’ın kalp yetersizliği tipi ile ilişkisi ( korunmuş EF [HFpEF] )veya düşük EF kalp yetersizliği [HFrEF]) ilişkisi ayrıntılı olarak incelenmemiştir. Hipertansif kalp hastaları ve aort darlığı olan, koroner arter hastalığı olmayan hastalrda yapılan iki çalışmada, HFrEF li hastalarda HFpEF li hastalara oranla miktar olarak MIF daha ciddi olarak gösterilmiştir. Diyabetik kardiyomiyopatisi olan kalp yetersizlikli hastaların biyopsilerini inceleyen bir çalışmada HFrEF de artan fibröz doku gözlenirken HFpEF li hastalarda fibröz doku izlenmemiştir. Hipertrofik kardiyomiyopatili kalp yetersizlik hastaların otopsi çalışmasında yine benzer bulgular vardır. Bu bulgular etiyoloji ve kalp hastalık sürecine bağlı olarak MIF ile sol ventrikül fonksiyonun, değişken bir yapı-fonksiyon ilişkisi ile belirlendiğini düşündürür. MIF direkt olarak sol ventrikül sertliğini artırarak HFpEF de diyastolik disfonksiyona sebep olurken, HFrEF de kardiyomiyosit ve kasılabilir doku kitle kaybının tetiklediği onarıcı yanıt olarak MIF gelişe bilir.
Aritmi
MIF in aksiyon protansiyeli ilerleyişini yavaşlatarak miyokardiyel elektofizyolojiyi değiştirdiği, re-eneteriyi başlattığı, art depolarizasyonları ve ektopik otomasiteyi artırarak kollektif olarak ventriküler aritmileri arttırdığına dair pek çok veri vardır. Örneğin hipertrofik kardiyomiyopatide MIF ile olan elektrofizyolojik değişikliklerin ventriküler aritmilere sebep olduğu gösterilmiştir. Yine hipertansif hastalarda sol ventrikül fonksiyonlarından bağımsız olarak MIF ın ventriküler aritmilere sebep olduğu gösterilmiştir. Hipertrofik kardiyomiyopati hastalarında, hipertansif ve noniskemik dilate kardiyomiyopati hastalarında MIF, ani kardiyak ölüm açısından bir risk faktörü olarak belirlenmiştir.
Miyokardiyal Hipoksi
MIF, ciddi olarak kardiyomiyozitlere oksijen taşınmasında azalma ile ilişkili bulunmuştur. Hipertansif kalp hastalığında veya hipertrofik kardiyomiyopatilerde görülen perivasküler fibrozis koroner akım rezervini azaltarak ters korolasyonda bir etki yapacaktır. Yine fibrotik doku oksijen diffüzyon mesafesini artırarak hipoksiye sebep olur. Hipertrofik kardiyomiyopatili, hipertansif veya diyabetik kardiyomiyopatili hastalarda vasküler duvardaki anormallikler ve kapillerin seyrekleşmesi ile belirlenen koroner mikrovasküler hastalığın ciddiyeti, MIF in ciddiyeti ile ilişkilidir. Sonuçta MIF iskemi/hipoksiyi artırır ve bu koroner mikrodolaşımdan ödün vererek daha fazla MIF gelişmesini artırır.
MIF Kötü Klinik Seyir İlişkisi
Eldeki klinik veriler MIF miktarı ve kalitesinin kalp yetmezliği hastalarında prognozu ve tedaviye yanıtı etkilediğini düşündürtmektedir. Hipertansif, diyabetik ,hipertrofik kardiyomiyopatili kalp yetmezliği hastalarında, tüm nedenlerden ölüm ve istenmeyen kardiyovasküler olaylar ve HFpEF li hastalarda hastaneye yatış veya mortalite fibrozisin yaygınlığı (histolojik veya MR ile ölçülen) ile ilişkili bulunmuştur. Biriken fiberlerin kimyasal yapısı bile klinik son nokta ile ilişkilidir. Örneğin hipertansif kalp yetersizliği hastalarında tip kollajen çapraz bağındaki artış kalp yetmezliği ile hastaneye yatış ile ilişkili bulunmuştur. Kollajen birikimi ile çapraz bağlardaki artış bir arada hipertansif kalp yetmezliği hastalarında hastaneye yatış ile ilişkili olduğu gibi mortalite ilede ilişkilidir. Benzer şekilde aortik kapak replasmanına giden aort darlığı hastalarında fibrotik birikim ne kadar yaygın ise mortalite o kadar yüksek, cerrahi sonrasında sol ventrikül fonksiyonlarında düzelme o kadar azdır.

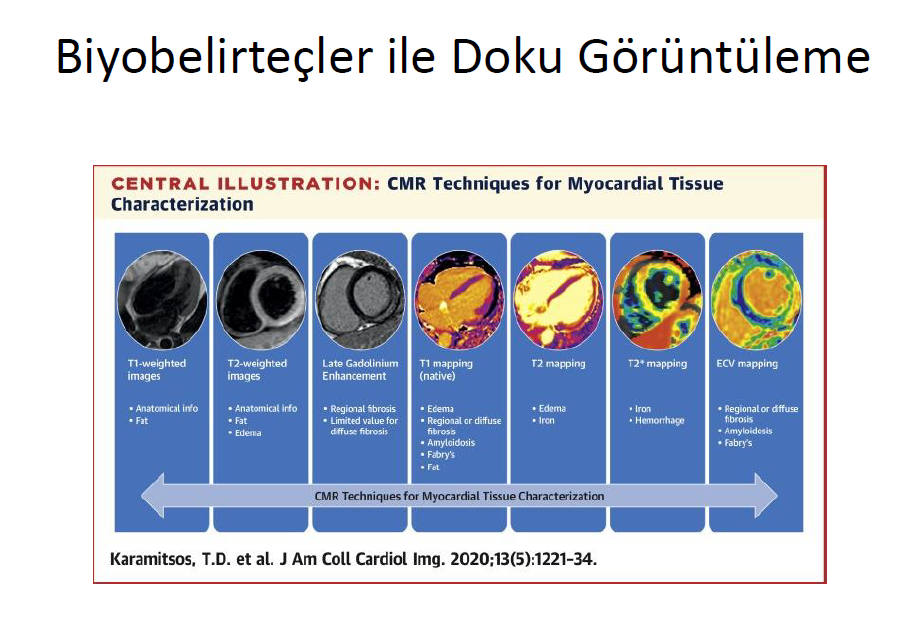
Kardiyak MR görüntüleme parametreleri ; Fibrotik miyokardiyumu değerlendirmede günümüzde kullanınan biyobelirteçler geç-gadolinium enhancement (LGE) ve T1 haritalama (native T1, kontrast sonrası T1 ve ekstraselüler volüm fraksiyonu [ECV]) olarak sıralana bilir. T1 haritalama ve ECV fibrozisin bölgesel mi yoksa diffüz mü olduğunu ayırmada daha özgüldür.
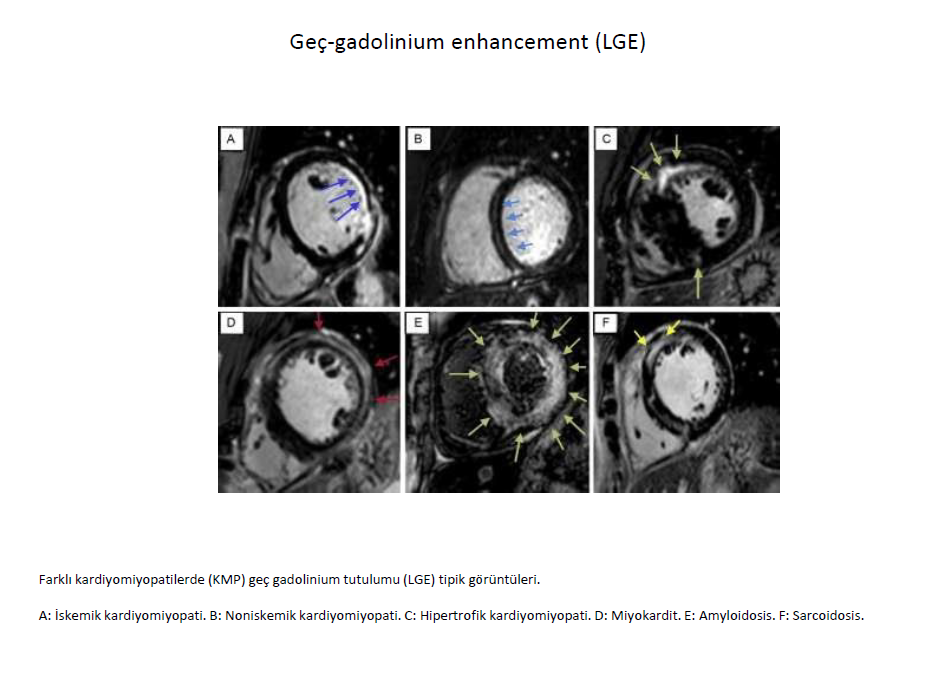
İskemik KMP; tipik olarak subendokardiyumu etkiler (subendokardial artış şekilde sol ventrikül midlateral ve posterolaterali).
Noniskemik KMP; Sık olarak morfolojisi; uzunlamasına olarak (miyokardiyal stria) orta duvar interventrüküler septumu tutan intramiyokardiyal fibrozis (epikardiyal,diffüz ve fokal paternlerde olabilir).
Hipertrofik KMP; genellikle duvar kalınlığının en fazla olduğu veya sol ile sağ ventrikülün birleşme segmentlerine sınırlanmış parçalı veya bir bölgede toplanmış paternde görülür.
Miyokardit; Fokal subendokardiyal veya intramiyokardiyal non iskemik skar şeklinde LGE görümü.
Amiloid ; Gadolinum kinetiğini belirgin olarak değiştirir, bu sebeple genel LGE görünümünden belirgin farklı görüntü oluşur, iyi görüntü oluşturulamayan miyokardiyumda fokal birikimler bize amilodozisi düşündürür.
Sarkoidoz; Tipik olarak yama tarzında orta duvar veya sub endokardiyal ve sıklıkla sol ventrikül anteroseptal ve anterolateral duvarını veya sağ ventrikülü tutan fokal skar alanları.
LGE fokal geniş post-infarkt skarları göstermede kullanılırken , T1 haritalama MIF dakine benzer diffüz kollajen çökertilerini gösterir.
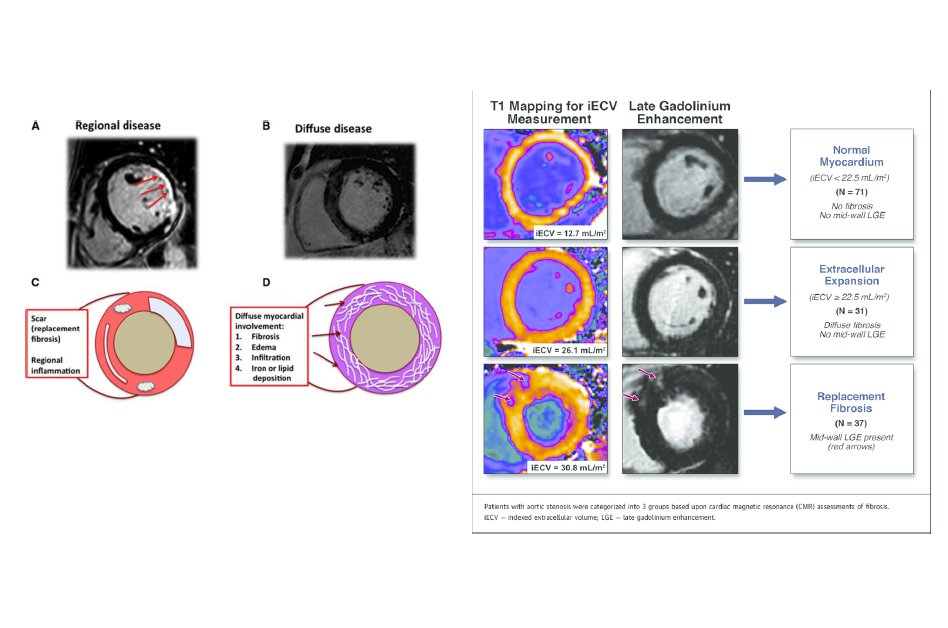
Kollajen volüm fraksiyonuna göre belirlenen ECV ye oranla ,LGE diffüz kollajen çökeltilerini göstermede birkaç küçük çalışmada daha etkin gibi gösterilmiş. Yine aortik darlıklılarda yapılan bir çalışmada ECV histolojik belirlenen MIF ile orantılı çıkmamış. LGE ve ECV MIF daki kollajenin türünü belirlemede başarılı değildir.
MIF için Serum Belirteçleri
PCP enzimi tarafından prokollajen tip I in olgun fibril oluşturan kollajen tip I e dönüştürülmesi sırasında oluşan prokollajen tip I in karboksi-terminal pro-peptitinin (PICP) seviyesinin ölçülmesi hipertansif kalp yetmezlik hastalarında kollajen çökeltisi miktarı ile histolojik olarak ilişkili bulunmuştur. Prokollajen tip III aminoterminal proteinaz tarafından prokollajen tip III ün olgun fibril oluşturan kollajen tip III e ekstraselüler olarak dönüştürülmesi sırasında ortaya çıkan prokollajen tip III amino terminal propeptit (PIIINP) seviyeleri iskemik ve dilate kardiyomiyopatili hastalarında miyokardial tip III kollajen çökelmesi ile ilişkili bulunmuştur. Ciddi aort darlığı olan hastalarda miyokart kollajen çapraz bağı ve sol ventrikül sertliği artışı dolaşımdaki mikroRNA 19b transkript seviyeleri ile ters orantılıdır. Yine yakın zamanda PICP ve kollajen tip I serum karboksi terminal telopeptitin (CITP), matriks metalloproteinaz 1 (MMP1) e oranının hipertansif kalp yetmezliğinde ciddi kollajen çökelmesi ve kollajen çapraz bağ ile ilişkili olduğu gösterilmiştir.
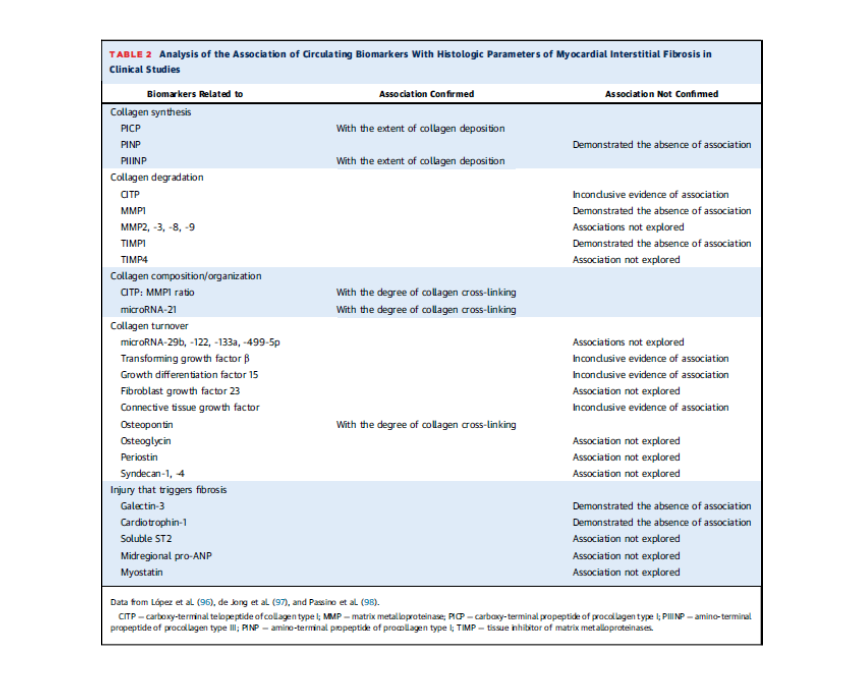
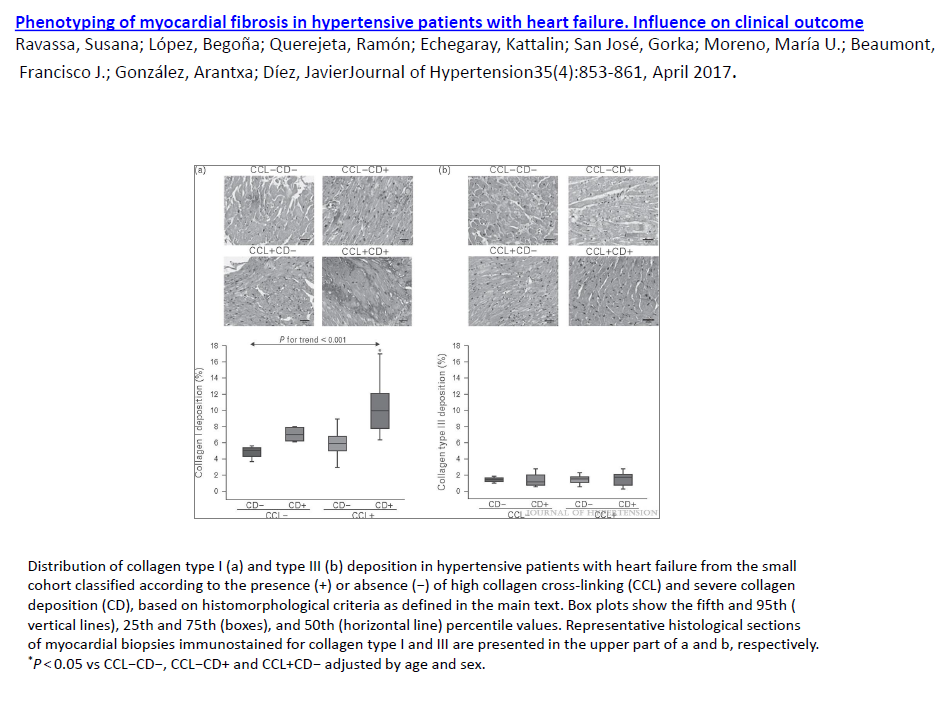
Biyobelirteçlere göre dört gurup ile yapılan çalışma;
Ilımlı PICP ve normal CITP-MMP1 oranı
Yüksek PICP ve normal CITP-MMP1 oranı
Ilımlı PICP ve düşük CITP-MMP1 oranı
Yüksek PICP ve düşük CITP-MMP1 oranı
Birinci sonlanım noktası ilk defa kalp yetersizliği ile hastaneye yatış veya kardiyovasküler ölüm.
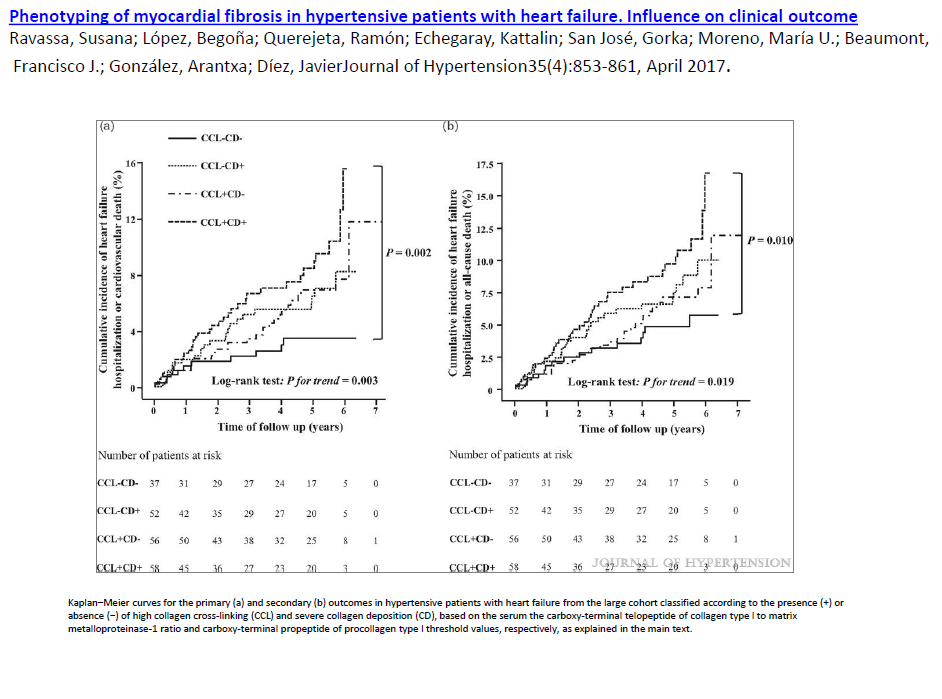
5.31 yıl takipte birinci guruptan sonuncu guruba doğru primer son nokta artmış. İkincil son noktalar olan kalp yetersizliği ile ilk hastaneye yatış ve ölüm ilk guruptan son gruba doğru yine artış göstermekte. Son gurupta yine atriyal fibrilasyon daha fazla görülmektedir.
Her ne kadar fibrozis gelişmesi kronik zedelenme sekeli olarak ve doku mimarisinin değişip yıkıldığı tek yönlü geri dönüşsüz bir tahribat olarak kabul edilse de son yıllarda geç evrelerde olsa bile fibrogenezin geri dönüşümlü olabileceğine dair bazı bulgular ortaya çıkmıştır. MIF için kronik doku zedelenmesinin geri dönmesi deneysel çalışmalarda gösterilmekle birlikte klinik kanıtlar her zaman bunu desteklemez. Örneğin aort darlığında kapağın değiştirilmesi, uzun süreli hipertansiyonda amlodipin ile kan basıncı kontrolü sonrasında kollajen çöküntülerinde belirgin değişiklikler izlenmemiştir. Eldeki klinik veriler renin-anjiyotensin-aldosteron aksını hedef alan ilaçların MIF e etkili olabileceğini göstermektedir.
MIF hastalarında hastaları klinik alt gurupla ayırmak tedavide farklılıklar yarata bilir. Örneğin MIF in histomoleküler karakteristikler olarak biyobelirteçler ile fenotiplere ayrıldığı çalışmalarda ( örneğin serum CITP:MMP1 oranı-temelli fenotipleme ile kollajen çapraz bağ kuvveti saptanan tipleme) HFpEF li yüksek kollajen tip I çapraz bağı olan hastalarda spironolaktonun sol ventrikül fonksiyonlarını artırmada etkisiz olduğu gösterilmiştir. Bu bulgular HFpEF de fenotiplemenin önemli olacağını düşündürmektedir. Diyabetik kalp yetmezliği olan basınç yüklenmesi olan fare çalışmalarında sacubitril/valsartan MIF i azaltmış, sol ventrikül fonksiyonlarını düzeltmiştir. Sacubitril/valsartan ın anti fibrotik etkisinin valsartana ek olarak Sacubitril den kaynaklandığı düşünülmektedir Ancak sol ventrikül fonksiyonları göreceli olarak korunmuş ( sol ventrikül ejeksiyon fraksiyonu > % 45) olan 4822 kalp yetmezlik hastasında yapılan yeni bir faz 3 çalışmada valsartana oranla sacubitril/valsartan son noktalarda sadece sınırda fayda gösterile bilmiştir (p > 0.06).
Anti-MIF Etkili Güvenli İlaçlar
Hipertansif kalp hastalarını anjiyotensin-conversing enzim inhibitörü lisinopril veya anjiyotensin reseptör blokörü losartan ile tedavi ettiğimiz zaman fibrotik çökeltilerin yaygınlığında azalma ve sonucunda da sol ventrikül diyastolik fonksiyonlarında ve sertliğinde azalma olduğu gözlenmiştir. Benzer şekilde yine mineralokortikoit reseptör antagonisti spironolakton un kollajen birikimini ve sol ventrikül sertliğini azalttığı ve diyastolik disfonksiyonu kalp yetmezliği hastalarında düzelttiği gösterilmiştir. Hipertansif hastalarda standart kalp yetmezlik tedavisine bir kıvrım diüretiği olan torasemidin eklenmesinin kollajen çökeltisinde, bu çökelti materyalindeki çapraz bağlarda ve skar alanlarındaki LOX birikiminde azalma sağlamıştır. Bu etkilere hastalarda sol ventrikül sertliğinde ve fonksiyonel sınıfta azalma eşlik etmiştir. Benzer MIF etkileri furosemid için gösterilememiştir. Bunlar umut verici çalışmalar olmasına rağmen kısa takipli küçük hasta sayıları ile yapılan çalışmalardır. Torasemit için uzun takipli randomize çalışmalar planlanmalıdır.
Yine sodyum-glukoz cotransporter 2 (SGLT2) inhibitorü empagliflozin in MIF i azalttığı ve diyabetik farede diyastolik fonksiyonları düzelttiği gösterilmiştir. SGLT2 nin miyokart da metabolik ve/veya hemodinamik bir etkisi olmadığı için bu etkinin pleiotropik olacağı düşünülmektedir. İnsanlarda SGLT2 inhibitörlerinin MIF azaltmasına ilişkin henüz bir çalışma yoktur. Ancak faz 3 klinik çalışmada kalp yetmezliği olan ejeksiyon fraksiyonu düşük diyabetik veya diyabeti olmayan hastalarda SGLT2 inhibitörü dapagliflozin kalp yetmezliği kötüleşmesini ve kardiyovasküler ölümü belirgin azaltmıştır. Bu çalışmadaki hastaların % 55 inde iskemik etiyolojiye bağlı kalp yetersizliği olduğunu unutmamak gerekir. Son olarak birkaç deneysel çalışmada, klinik olarak onay almış TGF-b inhibitörleri olan pirfenidon ve transilatın birkaç MIF modelinde kardiyak antifibrotik etkisi gösterilmiştir. Bu ilaçların uzun süre kullanımdaki hepatotoksik etkileri ve karaciğer yetmezliği yapması kullanımını kısıtlayacaktır.

Miyokart iskemisi ve enfarktüsü hem akut hemde kronik safhada kardiyomiyosit kaybı ve ESM de belirgin değişiklikler ile seyreder. ESM deki bu değişiklikler iskemik veya enfarkt geçiren miyokart segmentlerinde mekanik bazı değişikliklere sebep olur. Son yıllarda kanıtlar iskemik ve infarkt geçiren kalpte ESM in sadece yapısal değil aynı zamanda bazı yolakları uyararak inflamatuar ve onarıcı bazı işlemleri yaparak istenmeyen yeniden yapılanma patogenezinde rol aldığını göstermiştir. Çoğu hastada iskemik kalp hastalığının sebebi epikardiyal koroner arterlerde gelişen atheroskleroza bağlı oksijen sağlama ve ihtiyaç uyumsuzluğuna bağlıdır.
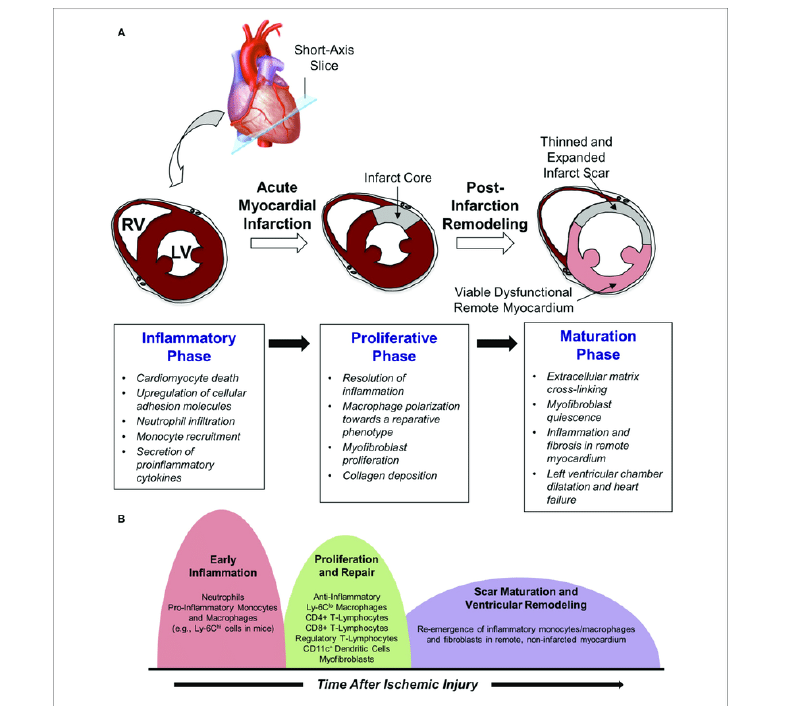
İnfarktüs Geçiren Kalplerde ESM
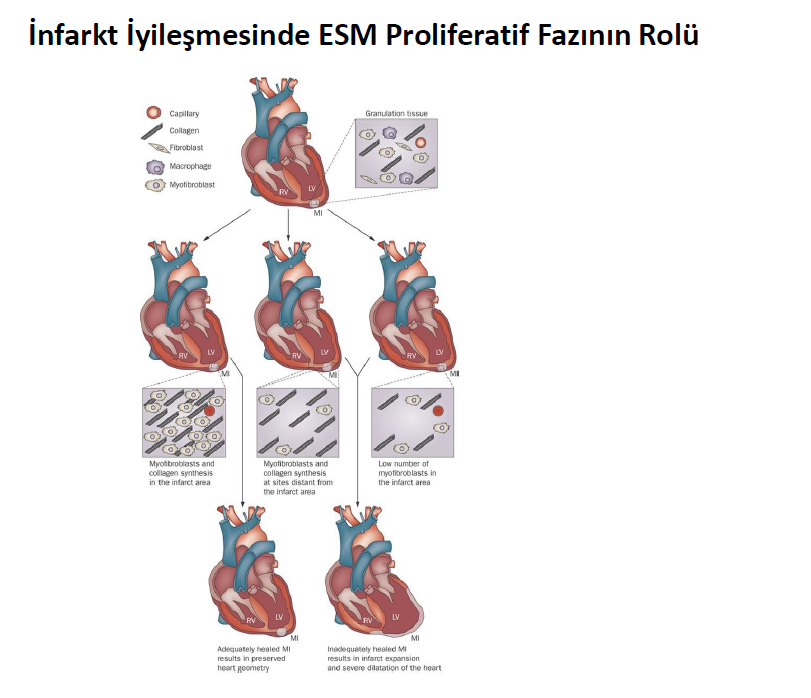
MI geçiren yetişkin memelilerde kardiyomiyositlerdeki masif kayıp, ileri derecede sınırlı endojen rejenerasyon kapasitesinden çok daha fazladır. Infarkta uğrayan miyokart , ölü dokunun matrix temelli skar ile yer değiştirmesi ile tedavi edilir. Miyokartdaki onarım yanıtı 3 birbirinden farklı kesişen faz ile gerçekleşir; inflamatuar, proleferatif ve maturasyon fazları. İnfarkta uğrayan segmentler iyileşirken infarkta uğramayan alanlar hemodinamik yüklenme, biriken immün hücreler etkisi ve infarkt sınır bölgesinde biriken fibroblastlara ile yeniden yapılandırılır (remodeling). Sonuçta ESM yapısındaki dinamik değişiklikler kalpte sadece yapısal ve mekanik değişiklikler değil aynı zamanda mimari değişikliklere (remodeling) sebep olacaktır.
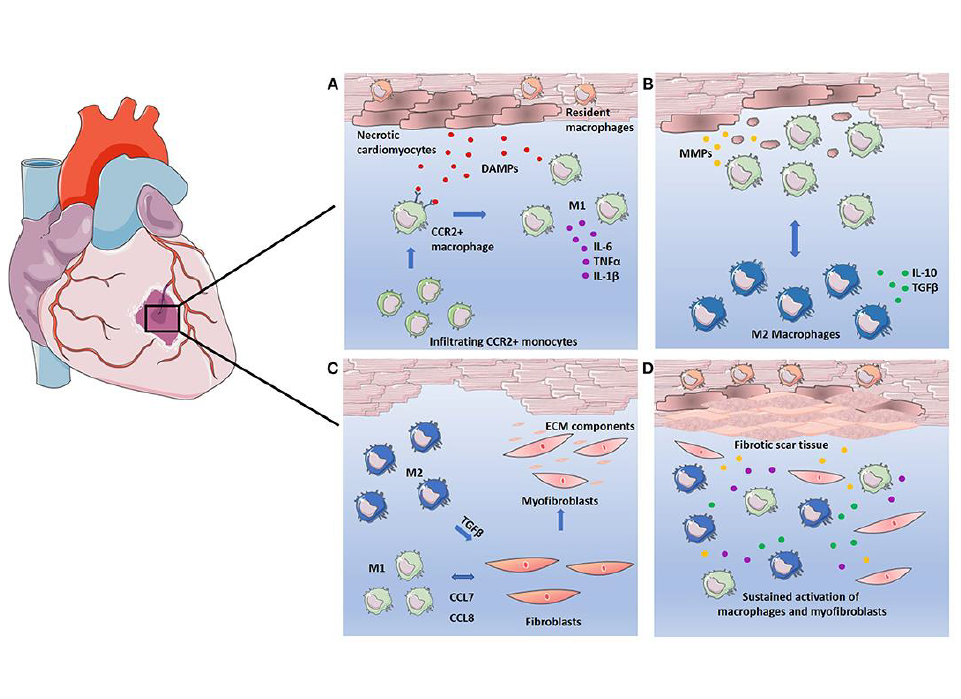
İnflamatuar faz sürecinde ; proteazların aktivasyonu ESM i yıkarak, immün hücre yolaklarını ve dolayısı ile inflamatuar reaksiyonu tetikleyen zedelenmeye bağlı protein parçacıklarını oluşturur. Ek olarak dışarı sızan plazma proteinleri ESM i zenginleştirerek immün hücreler ile tamir hücrelerinin bağlantısını oluşturan geçici plastik bir matriks ağı oluşturur. Ölü hücrelerin ve matriks artıklarının profesyonel fagositozlar ile fagozitoza uğratılması inflamasyonun inhibe olup, miyofibroblast aktivasyonu ve yeni damar oluşumu ile karakterize infarktın iyileşme dönemi yani proliferatif fazı başlatır. Kardiyak ESM in matrisellüler protein çökeltileri ile zenginleşmesi büyüme hormonu sinyal kaskatlarının o mekanda kalarak düzenlenmesini sağlayarak fibrotik yanıtın zedelenme bölgesinde sınırlı kalmasını sağlar. Ek olarak aktive fibroblastlar skar oluşturan büyük miktarda ESM yapısal proteini salarlar. Infaktüs olgunlaştıkça , ESM in çarpaz bağları yapısal stabilite sağlarken ventrikülün sertliğini artırmış olur. Canlı miyokart bölümlerinde ortay çıkan basınç ve hacim yükü, intersisyumda kollajenin kronik progresif birikimine sebep olarak post infarkt kalp yetmezliği patogenezinde önemli rol oynarlar.
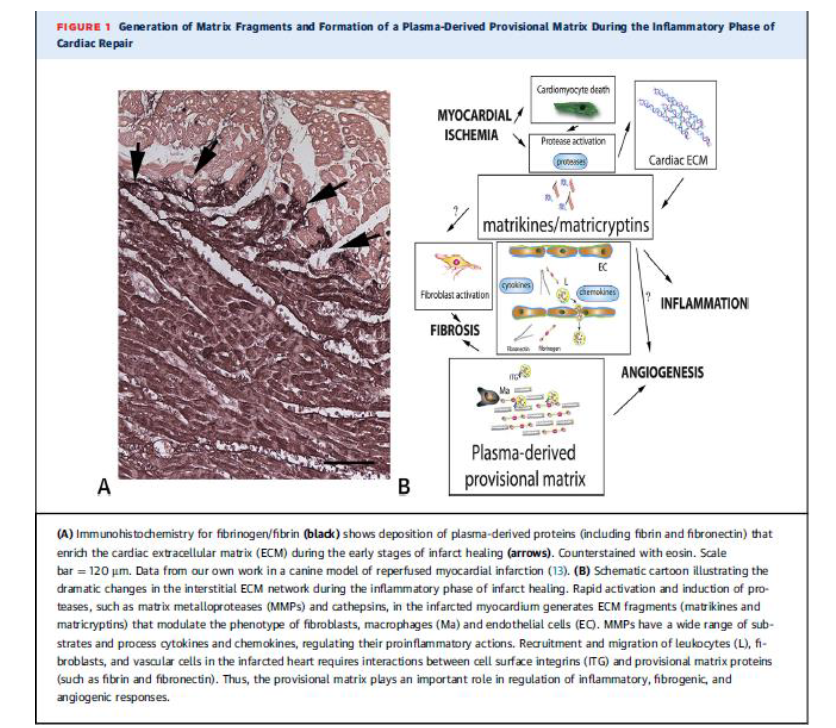
Proteaza bağlı ESM parçalanması inflamatuar, fibrojenik veya anjiyogenik yanıtları ayarlar. Biyolojik aktif matriks parçacıkları terminolojik olarak matrikinler veya matrikriptinler olarak tanımlanır. Her yerde kabul görmemekle birlikte matrikine bütünlüğünü kaybetmiş ESM molekülünü tarif etmekte kullanılır. Matrikriptin ise proteolitik süreçten geçerek biyolojik etkisini gösteren partiküldür. Enfarktüs sonrası miyokartdaki tüm ESM içeriği (Fibrillar kollajenler, elastin, bazal membran proteinleri, fibronektin, hyaluronan ve yeni salınan matricellular makromoleküller dahil olmak üzere) proteaz tarafından parçacıklara döndürüle bilir. Fibriler kollajen ve elastin parçacıklarının immün hücreleri uyardığı çalışmalarda gösterilmiştir.
MMP8, MMP9 ve proly endopetitazı içeren çok basamaklı proleotik döngü ile kollejenden yıkılan tripeptide proline-glycine-proline (PGP) ve asetile formu ac-PGP kemokin reseptör CXR, kemoatrakan etki göstererek inflamatuar yanıt oluşturur. Bu PGP oluşumunun basınç yükü olan kalplerde etkisinin gösterilmiş olmasına rağmen post-MI inflamasyonda etkisi gösterilememiştir. Gişe benzeri reseptör sinyal yolaklarını zedelenmiş dokularda potent proinflamatuar etki gösteren düşük molekül ağırlıklı hyaluronan parçacıklarını aktive eder. İlginç olarak bu parçacıkların temizlenmesinin geciktiği durumlarda lökosit ve vasküler hücrelerde proinflamatuar sinyalizasonun uzayıp, kuvetlenerek MI sonrası istenmeyen yeniden yapılanmayı (remodeling) artırdığı ileri sürülmüştür. Lamininlerin MMP2 ve MMP14 ile proteolitik işlemden geçirilmesi nötrofil kemoatrakan peptitleri artırırken infarktüs geçirmiş kalpte fibronektin parçacıklarının kemokine yanıtı ile monositin göç etme kabiliyetini azaltığı ileri sürülmüştür. Matrikinler ve matrikriptinler infarkt iyleşmesinin sadece inflamatuar fazında etkili değildirler ayrıca MI sonrası birkaç gün daha proteazların uzamış aktivitesi ve ESM parçalanması devam eder. Matriks parçacıkları immün hücreler dışında fibroblast ve vasküler hücre fenotipinin düzenlenmesinde etkili olur.
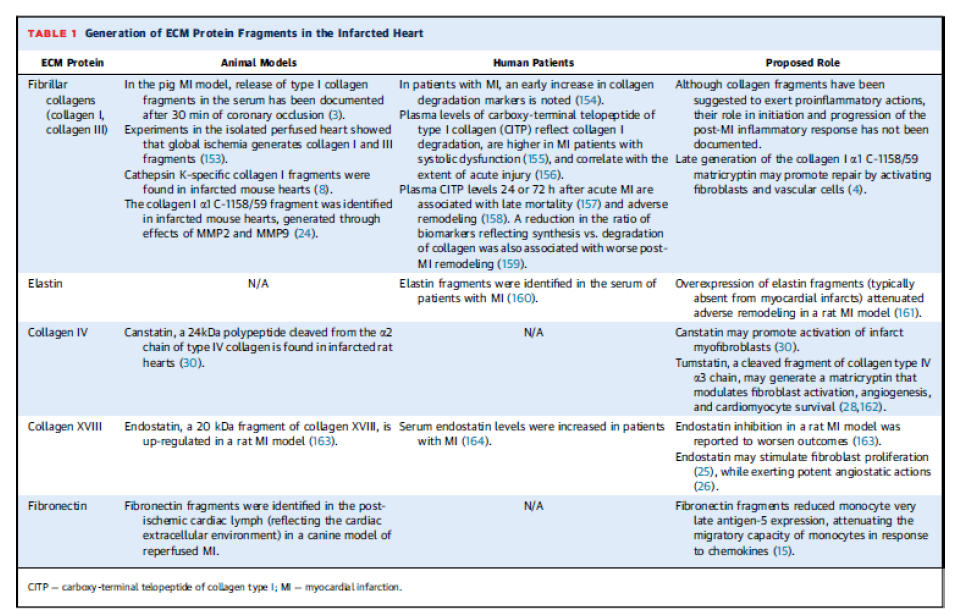
Kollajenin XVIII 20 kDa parçacığı olan endostatin fibroblast proliferasyonunu uyarırken anjiyostatik etki gösterir.Kollajen IV ün MMP9-aracılı parçalanması ile ortaya çıkan tumstatin in anjiyostatik özellikleri vardır, daha fazla parçacıklara ayrıldığında ise kardiyak fibroblastların çoğalan ve göç eden fibroblast fenotipi oluşmasını destekler. Kollajen IV den oluşan Kanstatin fragmanı yine fibroblastları aktive ederek proliferasyonunu artırır ve fibroblast yoluyla salınan MMP sentezini artırır.
Inflamatuar Yanıtın Düzenlenmesinde MMP ler
MMP ler ECM nin yeniden yapılanması dışında sitokin, kemokin ve büyüme faktörlerini işlemden geçirerek inflamatuar ve onarıcı döngüleri düzerlerler. MMP ailesinin birkaç üyesi tümör nekroz faktörünün hücre membranına bağlı öncülü üzerine yaptığı etki ile aktif sitokin oluşturur. MMP3 ve MMP2,MMP9 jelatinazları, prointerlökin-1b yi işlemden geçirerek kaspaz-1 den bağımsız sitokinin aktif formlarını oluştururlar. Salınan saklı kalmış komplekslerden, olgun transforme edici büyüme faktörü (TGF)-b oluşmasında MMP lerin döngü üzerine etkilerinin etkili olduğu gösterilmiştir. MMPler, CXCL12/stromal cell-derived factor (SDF)-1 ve CCL2/monocyte chemoattractant protein (MCP)-1 gibi kemokin ailesi bazı üyelerini işlemden geçirerek kemokinin bazen aktivitesini artıran, bazende azaltan zıt etkiler göstere bilmektedir. Yine MMP ler , endotel hücre yüzeyleri ve aktive lökositler ile etkileşime girerek kemokin hareketlerinin kısıtlanmasında kritik rol oynayan glikosaminokan bağlanma yerlerini parçalayarak kemokin gradienti oluştururlar.
MMP ailesi üyelerinin sitozol, mitokondri veya nukleus gibi subselüler lokasyanlarda bulunması kardiyak onarımda oynadığı rolü anlamamızı zorlaştırıyor. MMP lerin sitoskeletal proteinler, sinyal iletkenleri, enzimler ve transkripsiyon düzenleyicileri gibi geniş bir substrat yelpazesine etkili olduğu bilinmektedir. MMP ye bağlı miyozin ve aktin gibi kontraktil proteinlerin parçalanmasının iskemik miyoardiyal fonksiyon bozukluğunda rol aldığı düşünülmektedir. İnvitro çalışmalarda MMP lerin sinyal iletim veya transkripsiyonunda proteolitik etkileri dışındada etkili olduklarını düşündürmüştür.Bu bulgular invivo olarak halen gösterilmemiştir. Kemokin ve sitokinlerin lökosit görevlendirilmesi, onarım ve yeniden yapılanmasında yaptığı kritik müdahaleler düşünülecek olur ise infarkt sonrası kalpte MMP aracılı inflamasyon bağımlı işlemler merkezi düzenleyici rol oynamaktadır.
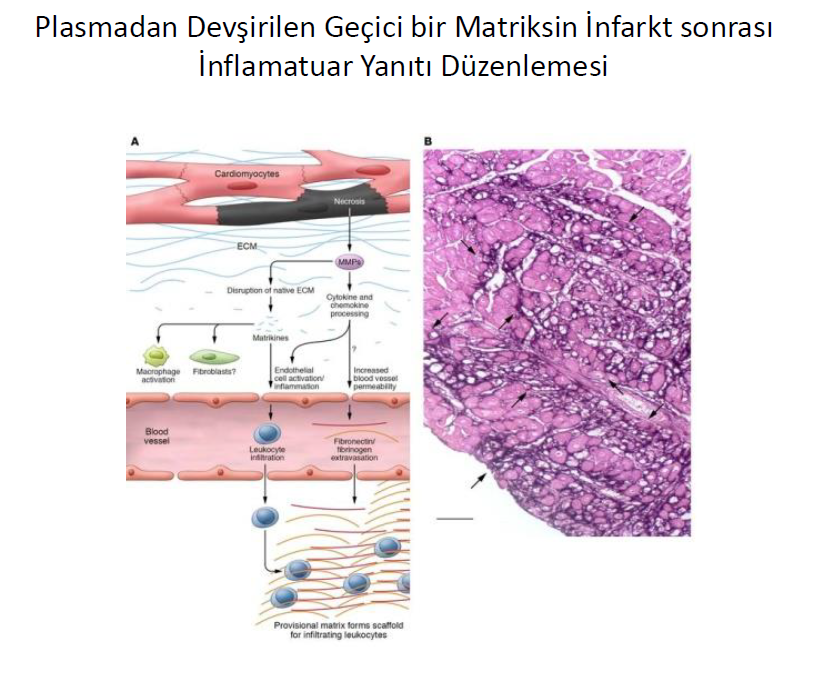
Native miyokardiyal ESM in proteolitik etki ile parçalanmasına eşlik eden immün, vasküler ve onarım hücrelerinin göçünü ve hücre farklılaşmasını destekleyen yüksek oranda plastik geçici bir matriks ağı oluşumu skar oluşmasına katkıda bulunur. Damar ve deri zedelenmesinde bu geçici matriks içeriğindeki değişimlerin etkisi gösterilebilmiştir. Erken evrede bu geçici matriks, ağırlıklı olarak damar dışına sızan proteinlerden oluşur (fibrojenden oluşan fibrin ve plazma fibronektini gibi). İmmün hücreler ve fibroblastlar zedelenmiş dokuya göç ettikçe, hücrelerden temin edilen fibronektin ve proteoglikanlar geçici matriks içeriğinde zenginleşir. İnfarkt alanında damar dışına oluşan fibrinojen ve fibronektin sızıntısına, ani olarak olarak ortay çıkan sitokinlerden salınan tümör nekrozis faktör-a ve vasküler endotelial büyüme faktörü sebep olabilir (VEGF). Bu geçici matriks içeriğinin MI sonrası inflamatuar yanıta olan etkisi invivo deneylerle çok iyi desteklenememiştir.
İnfarkta uğrayan miyokartdan ölü hücrelerin ve matriks enkazının temizlenmesi, inflamasyonu baskılayarak farklı lökositlerin görevlendirilmesi ve onarım ortamının oluşmasını tetikler. Infarkt alanındaki makrofajlar fenotipik değişime uğrayarak miyofibroblast aktivasyonunu artırır, inflamasyonu baskılayan farklı mediyatörler salmaya başlarlar (TGF-b ve interlökin-10 gibi). Yerel kardiyak fibroblastlar miyofibroblasta dönüşerek düz adele hücresi aktin gibi kontraktil proteinlerin açığa çıkmasına ve infarkta uğrayan miyokartın katastrofik olarak ruptüre olmasını engelleyen kollajen ve diğer ESM proteinlerinin salınmasını sağlarlar. Makrofajlar gibi infarkt alanındaki diğer hücrelerde kollajen salsalar bile, yapısal ESM proteinleri üretimleri kısıtlıdır, iyileşen kalpte en önemli kollajen sentezini miyofibroblastlar yaparlar. Miyofibroblast aktivasyonu için makrofajlar, lenfositler, vasküler hücreler ve sınır bölgesi kardiyomiyositleri gibi hücrelerin işbirliği içinde çalışması ve büyüme faktörleri, matriselüler proteinler salarak ESM i fibroblastı aktive eden mediatörleri infarkt alanına toplayan bir sinyalizasyonun merkezi haline geetirmesi gerekir.
Kardiyak onarımda proleferatif faza geçilmesi geçici matriks içeriğinde dramatik bazı değişiklikler ile belirlenir. Plazmadan devşirilen fibrin temelli geçici matriks ağı fibrinolitik enzimler tarafından yıkılır. İnvivo çalışmalarda fibrin temelli geçici matriksin, plasminojen/plazmin sistemi tarafından vakitlice temizlenmesinin onarıcı yanıt açısından kritik rol oynadığını göstermiştir. Plazminojen eksikliği olan farede infarkt iyileşmesinde onarıcı hücre görevlendirilmesi ve ölü miyositlerin granülasyon dokusu ile yer değişiminde karışıklıkların infarkt iyleşmesinde defektlere yol açtığı gösterilmiştir. Fibrin ağı eridikçe aktive olan makrofajlar ve interstisyel hücreler fibronektin, hyaluronana ve proteoglikan içeren hücreden devşirilen bir ESM oluştururlar.
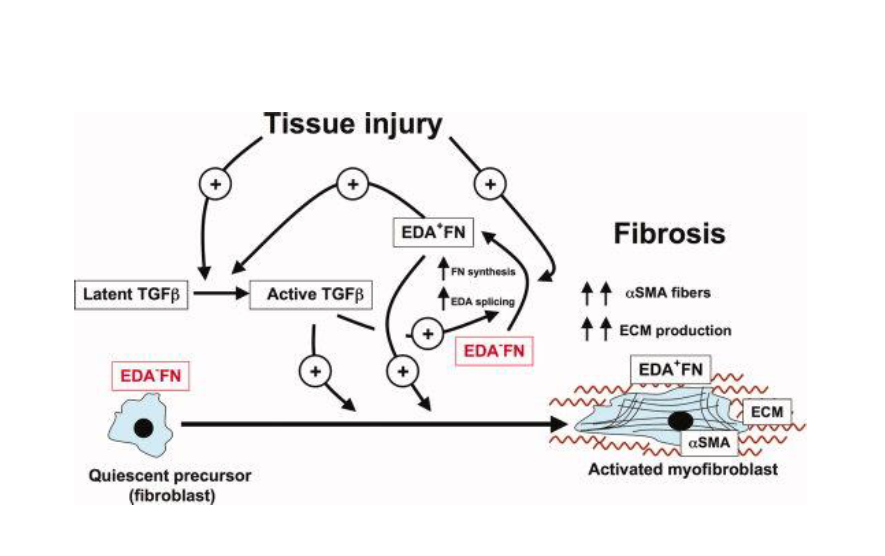
İnvitro ve invivo bulgular ED-A fibronektin bağlantı yerinin değişime uğramasının TGF-b1 e bağlı miyofibroblast dönüşümünde etkili olduğunu göstermiştir. Çok iyi bilinmemekle birlikte ED-A fibronektinin ESM de gizlenmiş büyük TGF-B kompleksini fibroblast biriken alanlara sabitlediği düşünülmektedir. Proteazlar, hücre yüzey integrinleri ne matriselüler proteinler koopere olarak çalışarak gizli depolardaki aktive TGF-b dimerlerini serbestleştirerek fibrojenik sinyal yolağının baskılanmasını tetikliye bilir. Fibronektin TGF-b ile fibroblast aktive edici yanıt dışında anjiyogenezde de önemli rol oynaya bilir.Fibronektinin heparin II alanı VEGF ile bağlanarak endoteliyal hücrelere anjjiyojenik etki yaparak infarkt alanında yeni damar oluşumunu artıra bilir.
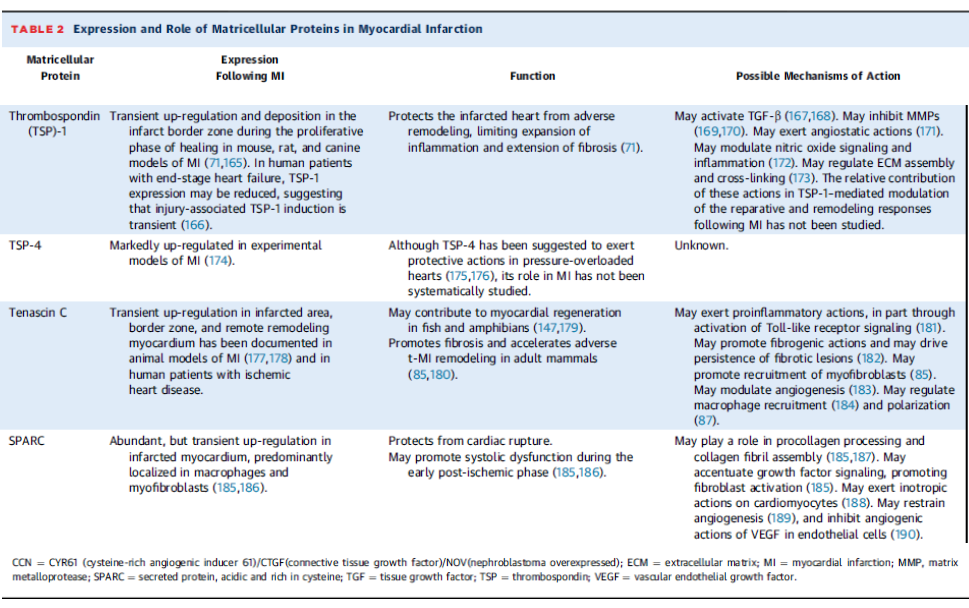
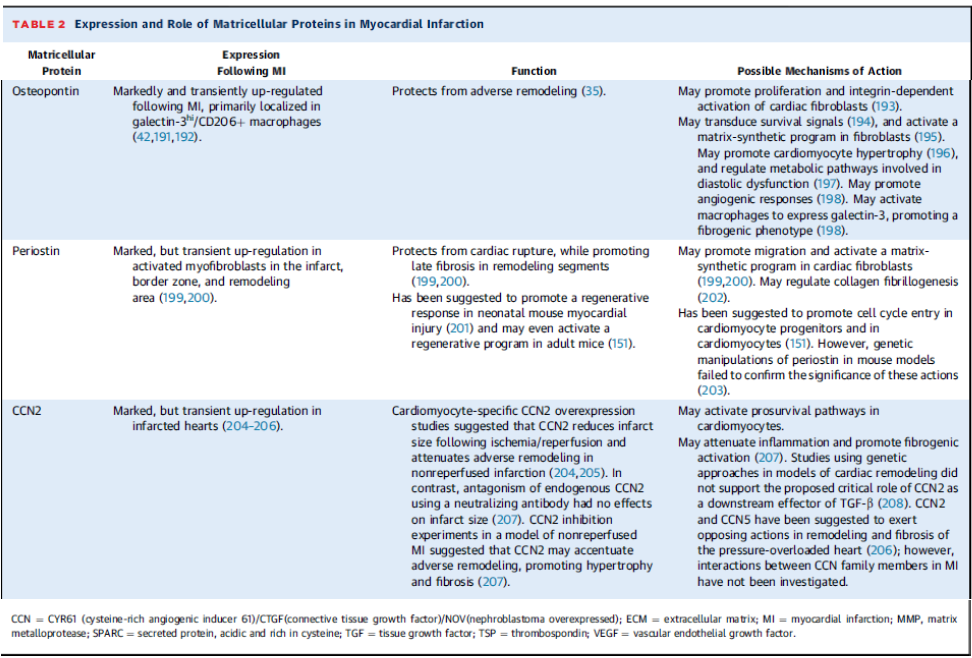
MATRISELLÜLER PROTEİNLERİN ETKİLERİ
‘Matrisellüler protein terimi’ zedelenme ile ortaya çıkan, sinyal döngülerini uyararak hücre fonksiyonlarını düzenleyen yapısal olarak birbiri ile bağlantısı olmayan ESM parçacıklarını ifade eder. Zedelenen ve yeniden yapılanmaya uğrayan dokularda fazlaca baskın olan, matriselüler proteinler yapısal görevler açısından pek fazla görev yapmazlar ancak yapısal matriks proteinlerine ve hücre reaseptör yüzeylerine (integrinler veya sindekanlar gibi) bağlanarak sitokinlere ve büyüme faktörlerine sinyal iletirler, proteazlar ve bioaktif mediatörleri uyarırlar.
Bunlar
Secreted protein, acidic and rich in cysteine (SPARC);
Thrombospondinler (TSP)-1, -2, and -4;
Tenascin-C ve X;
Periostin;
Osteopontin;
CCN (Cystein rich protein 61/ Connective tissue growth factor)/Nephroblastoma overexpressed gene) ailesi üyeleri
Galektinler, fibulinler, ve küçük leucineden zengin osteoglisin gibi proteoglykanlar salınan ve bir miktar matriküloselüler etkileri olan diğer proteinlerdir.
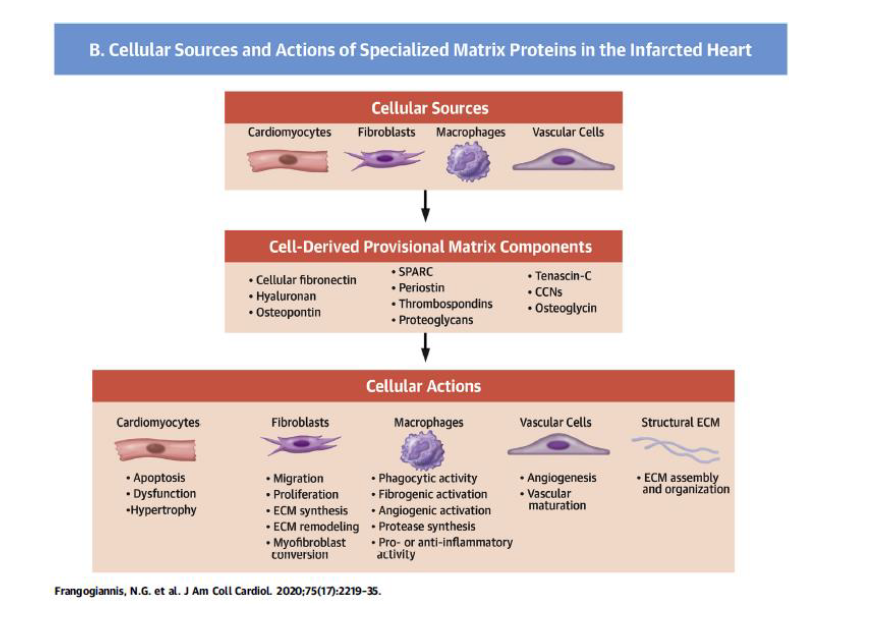
İnfarkt iyleşmesindeki kompleks matriks ortamını şematize eden şekil.
Hücreden devşirilen fibronectin, hyaluronan, ve geniş matrisellüler protein yelpazesi (OPN, TSP-1, TNC/tenascin-C, periostin, SPARC, osteoglycin, ve CCN ailesi üyeleri) ve proteoglikanlar infark ESM ni zenginleştirir ve kollajen bazlı yapısal matriks düzeneğini planlarken kardiyomiyositlerden, fibroblastlardan, makrofajlardan ve vasküler hücrelerden değişken hücre yanıtlarını tetiklerler. CCN = CYR61 (cysteine-rich angiogenic inducer 61)/CTGF(connective tissue growth factor)/NOV (nephroblastoma overexpressed).
Hücrelerden devşirilen geçici matriks bir çok matriselüler makromolekül ile zenginleşerek fibroblast, immün hücreler, vasküler hücreler ve hayatta kalan sınır kardiyomiyosit hücrelerinde kilit sinyallerin iletimini sağlar. Fibroblastların aktive miyofibroblastlara dönüşmesi için makrofajlardan TGF-b salınması ve saklı lokal TGF-b nin infarkt alanında aktif hale gelmesi gerekir. Matriks ağının özgül paçacıklarının birikimi, iyileşen infarkt bölgesi ile sınırlı TGF-b aktivasyonu için önem arz eder.
Infarkt Alanında Fibriller Kollajenlerin Birikimi
Yeni oluşan fibriler kollajen sentezi (örneğin kollajen I ve III) iyleşen skar bölgesine mekanik kuvvet katarak infarkta uğrayan miyokartı rüptüre olmaktan korur ve yeniden yapılanmayı (remodeling )artırır. Infarkt myofibroblastları nörohumoral uyarı ve büyüme faktörlerinin uyarısı ile büyük miktarda kollajen salarlar ve iyleşen kalpte en fazla kollajen sentezleyen hücrelerdir. MI'nin deneysel modellerinde, tip III prokollajen erken dönemde artarken geç dönemde prokollajen I sentezinin belirgin arttığı gözlenir. Kollajen I ve III'ün göreceli olarak baskın olan türünün kardiyak uyumu etkileyeceği ileri sürülmüştür. Kollajen I kalın ve sert lifler oluşturur; buna karşılık, ince retiküler kollajen III lifler daha uyumludur ve enfarktüslü ventrikülün elastikiyetini artırıyor olabilir. Enfarktüs bölgesi myofibroblastlarının prokollajen sentezini enfarktüs bölgesinde çözünür prokollajen proteininin salgılanması izler.
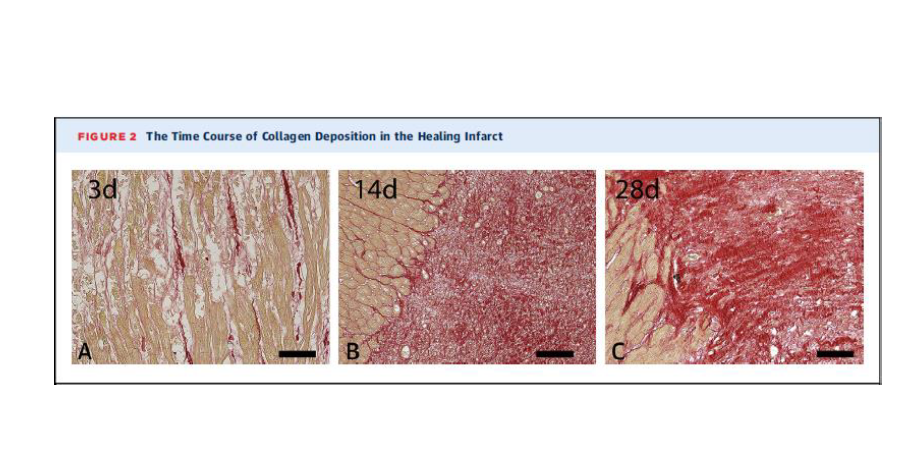
Şekil
Reperfüzyon miyokardiyal MI'de (1 saat koroner oklüzyon ve ardından reperfüzyon) 3, 14 ve 28 gün sonra kollajen liflerini tanımlamak için köpek enfarktüs sınır bölgelerinin picrosirius kırmızı ile boyanması. Kollajen, kırmız, kardiyomiyositler , açık kahverengi lekeleme ile tanımlanır. Üçüncn günde sınırlı de novo sentezi eşliğinde kollajen ağında kesintilere dikkat edin (A), 14 gün sonra, iyileşen enfarktüste kapsamlı kollajen birikimi dikkat çekiyor (B),olgun skar (28 gün [C]), tipik olarak kollajen çapraz bağlama ile ilişkili yoğun bir matris ağı sergiler.
Organize bir skar oluşabilmesi için prokollajen zincirlerinin ve fibrilllerin bir arada monte edilmesi kritik öneme sahiptir. Prokolajene bağlı C-terminal propeptidinin bölünmesinde, enfarktüslü kalpte indüklenen C proteinaz kemik morfogenetik protein 1 rol alır. Salgılanan frizzle ile ilgili protein 2 (Sfrp2) de enfarktüs fibroblastlarında artış gösterir ve muhtemelen kemik morfogenetik protein 1-prokollajen ile etkileşime girerek kollajen işlenmesinde görev alır. Ek olarak, kollajenin işlemden geçirilmesinde SPARC gibi matrisellüler proteinlerde görev alır.
NONFİBRİLLER KOLLAJENLERİN ROLÜ
Miyokard enfarktüsünde nonfibriller kollajenler de görev alırlar: Bunlar ESM de büyük fibriller demetler oluşturmayan, ancak tip I veya tip III kollajen ile tuturma, iletişim ve organizasyon etkileşimini sağlayan kollajen alt familyasıdır. Ailenin diğer üyeleri proteolitik olarak bölünerek fibroblast veya vasküler hücre fenotipini düzenleye bilecek biyoaktif parçalar üretirler. MI'de en iyi çalışılan nonfibriller kollajen olan kollajen VI'nın koruyucu etkileri olduğu, enfarktüsün boyutunu azalttıği ve olumsuz yeniden yapılanmayı azalttığı öne sürmüştür. Kollajen VI'nın kardiyomiyosit sağkalımındaki özgül, koruyucu etkiyi onarım yapan miyofibroblastları uyararak yaptığı öne sürülür.
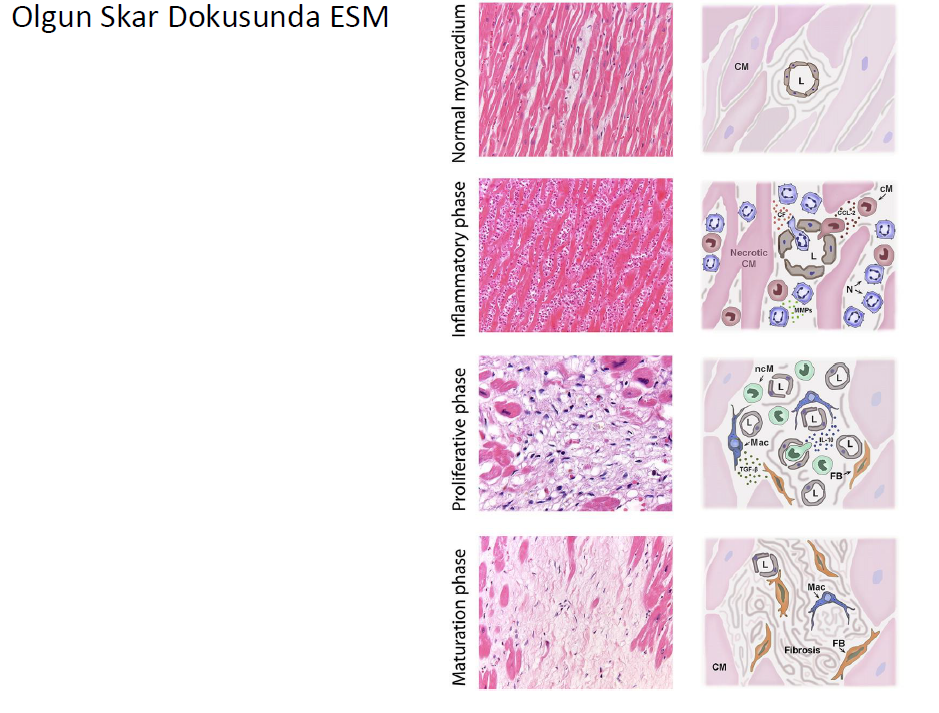
İyileşen enfarktüsün olgunlaşması kollajenöz ESM de çapraz bağların ve skar dokusu hücresel içeriğinin azalması ile olur. Olgun skar dokusunda fibrojenik aktivasyonun nasıl baskılandığı halen bilinmemektedir. Skar dokusu olgunlaştıkça, enfarktüs bölgesinde aktif miyofibroblastların yoğunluğu giderek azalır. Bazı çalışmalar enfarktüs fibroblastlarının apoptotik bir program ile, hücreye özgü aktivasyonunun söz konusu olabileceğini düşündürmektedir. Büyüme faktörlerinin tükenmesi ve fibroblast sağ kalımı için gerekli olan matrisellüler proteinlerin temizlenmesi, olgun enfarktüste fibroblast ölümünü açıklıya bilir. Son zamanlarda bazı gen izleme çalışmaları, fibroblastların olgun enfarktüste varlıklarının devam ettiğini, ancak tendon genleri üreten ve skar dokusunu desteklemek için uzmanlaşmış olabilecek belirgin bir fenotipe geçiş yaptıklarını öne sürmüştür. Vasküler hücreler, matür enfarktüs ESM ortamında, mikrodamar yapı morfolojisini ve işlevini etkileyen değişikliklere uğraya bilir. Skar olgunlaştıkça, trombosit türevli büyüme faktörü reseptörü (PDGFR)-b sinyalizasyonunun aktivasyonu yoluyla enfarktüs mikrovasküler yapısının çeperi bir kat hücre ile kaplanırken, kaplanmayan damarlar yıkılıp temizlenirler.
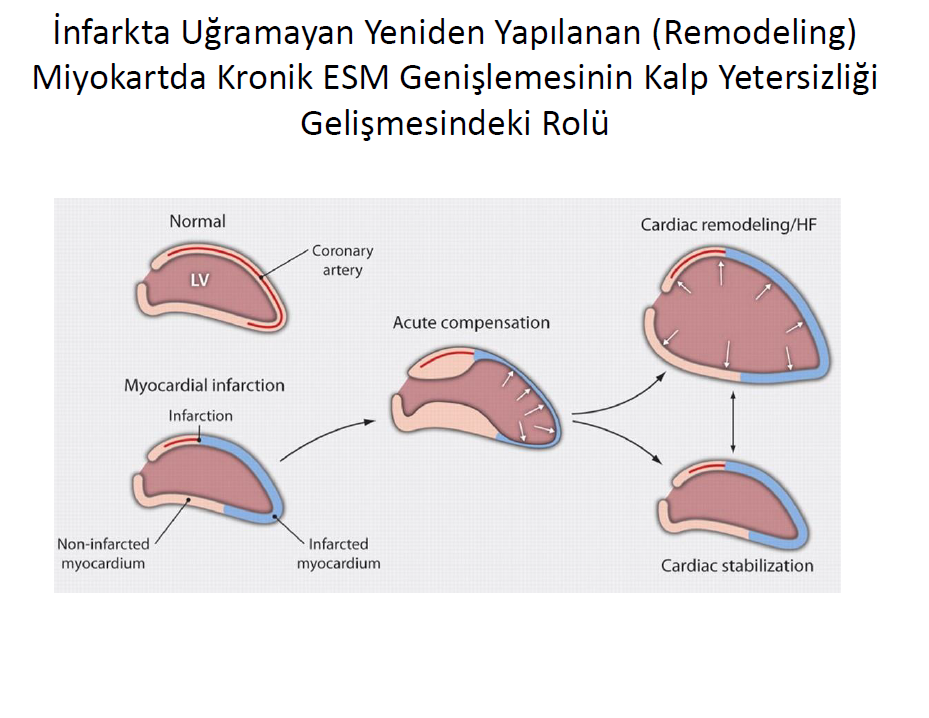
Büyük bir MI varlığında, büyük alanda kontnaktil doku kaybı, ventrikül dolum basınçlarının artmasına ve sonucunda da tipik olarak canlı olan diğer segmentlerde ilerleyici fibrotik değişikliklere neden olur. Bu sebeple interstisyel kollajenin infarct olmayan bölgede birikmesi, basınç ve hacim yüklerinin patofizyolojik etkisi ve nörohumoral yol aktivasyonu ile gelişebilir. Ayrıca, canlı segmentlerde artan duvar stresi, lokal olarak makrofajlarda ve fibroblastlarda mekanosensitif basamakları aktive ederek, MIF'i ve kardiyak interstisyel matriks ağının genişlemesini tetikleyebilir.
Kronik İskemİk Kardİyomİyopatİde ESM
ESM ağındaki değişiklikler, belirgin bir MI ın olmadığı durumlarda bile iskemik kardiyomiyopatili hastalarda gösterilmiştir. Kronik iskemik kardiyomiyopatisi olan hastalar tipik olarak MIF mevcuttur ve MMP ekspresyonu artışı ile ilişkili miyokard kollajen seviyelerinde artma ve tenascin-C gibi matriks proteinlerinde birikim olur. ECM birikimini ve yeniden yapılanmayı (remodeling) derinden etkileyebilecek komorbiditelerin (hipertansiyon, diyabet ve metabolik disfonksiyon dahil) yüksek prevalansının sık olduğu iskemik kardiyomiyopati hastalarında, kronik iskeminin matriks yeniden yapılanması (remodeling) üzerine etkisi göreceli olarak tartışmalıdır. Kısa süreli iskemik atakların veya düşük akım iskemilerinin miyokard ESM üzerindeki etkilerini inceleyen patofizyolojik çalışmalar sınırlıdır. Bazı hayvan çalışmaları, iskeminin enfarktüs yokluğunda bile ESM ağında önemli değişikliklere neden olabileceğini göstermektedir. Bu durumda kardiyomiyosit nekrozu yokluğunda bile düşük süreli veya yoğunlukta tekrarlayan iskemik olayların kardiyak ESM in yeniden yapılanmasını (remodeling) tetiklene bileceği düşünülmektedir.

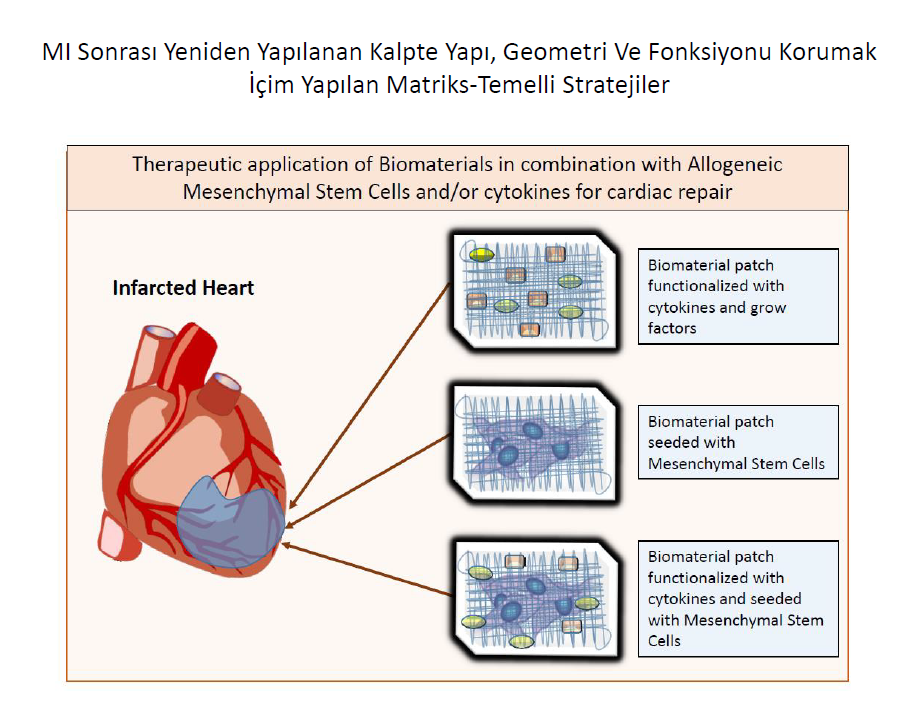
Kardiyak yapısal bütünlük ve fonksiyonun korunmasındaki önemi ve kardiyak yaralanma, onarım ve tadilatta hücresel yanıtların düzenlenmesindeki rolü nedeniyle, kardiyak ECM terapötik müdahaleler için benzersiz fırsatlar sağlayabilir. Akut MI sonrası kardiyak rüptür, tipik olarak artmış matriks dejenerasyonu , yeni yapısal matrisin bozuk bir şekilde yapılanması veya skar dokusunun iyi organize olamamış yeniden mimarisi ile ilişkili nadir ama dramatik bir komplikasyondur. ECM proteinleri içeren yamaların uygulanması, akut sol ventrikül serbest duvar yırtılmasında ventrikülün yapısal bütünlüğünü geri kazandırmak için yeterli olabilmektedir. Biyolojik çatı görevi gören yamaların etkileri deneysel MI modellerinde kapsamlı bir şekilde incelenmiştir. Hücre içeren veya içermeyen ESM biyolojik çatı görevi gören yamaların implantasyonu veya enjekte edilebilir malzemelerin uygulanmasının, enfarktüslü kalpte faydaları bildirilmiştir. Bu etkiyi sadece mekanik destek yolu ile değil, aynı zamanda enflamatuar ve onarıcı sinyalleri uyararak ve anjiogenezi uyararak yapmıştır.
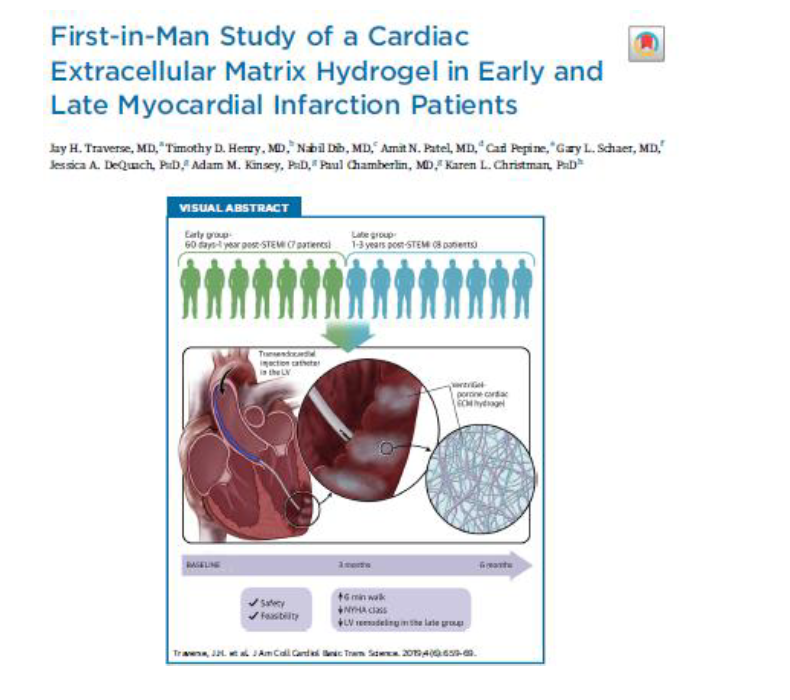
Son zamanlarda, deselülarize domuz miyokartından elde edilen bir kardiyak ESM hidrojeli olan VentriGel'in (Ventrix, San Diego, California) transendokardiyal enjeksiyonu, MI'yi takiben kronik remodeling ve orta derecede sol ventrikül disfonksiyonu olan 15 hastada test edildi. Çalışma yaklaşımın güvenliğini ve fizibilitesini desteklemesine rağmen, etkinliği değerlendirmek için tasarlanmamıştır ve ESM hidrojellerinin etkinliğini test eden büyük randomize klinik çalışmalar yapılmamıştır. Daha da önemlisi, kapsamlı deneysel çalışmalara rağmen, şu anda MI'yi takip eden biyomalzemelerin optimal bileşimi ve uygulama yöntemi konusunda bir fikir birliği yoktur.
ESM in enfarktüslü kalbin onarımı ve yeniden şekillendirilmesindeki kritik rolü, matrisin biyokimyasal bileşimini ve mekanik özelliklerini etkileyen terapötik yaklaşımların MI'li hastalar için umut vaat edebileceğini göstermektedir. Anjiyotensin dönüştürücü enzim inhibisyonu, anjiyotensin tip 1 reseptör blokajı, b-adrenerjik reseptör antagonizması ve mekanik boşaltma gibi klasik terapötik yaklaşımlar, ESM proteinlerinin birikimini ve metabolizmasını etkiler ve aslında ESM ağını hedef alarak koruyucu eylemlerini (en azından kısmen) uygular. Bununla birlikte, hedef matris remodelingini düzeltme yaklaşımları, enfarktüslü miyokarddaki proteazların değişken etkileri ve yine MI'li hastalarda MMP'leri inhibe etme girişimlerinin değişken sonuçlar vermesi sebebi ile çalışmaları sınırlamıştır.
Matriksselüler Protein Hedefli Tedaviler
Matriksosellüler proteinler ile tedaviye dayanan stratejiler, enfarktüs bölgesinde büyüme faktörünün lokalize olarak uyarılmasına ve sitokin sinyalini etkiemeye yönelik tedaviler özellikle çekici görünmektedir. Matriksoselüler proteinlerin infarktlı kalpte etkilerinin ileri derecede kompleks olması, bu bulguların tedavi yöntemlerine uygulana bilmesini şimdilik sınırlamıştır. Matrisellüler proteinlerin aynı protein üzerinde farklı bölgeleri yine farklı etkilemesi tedavi için kullanımı yine sınırlamaktadır. Proteinin faydalı ve zararlı bölgelerinin tanımlanıp invivo modellerde tedavide kullanılması halen zorlayıcı bir tasarım gibi görünmektedir.
Kardiyak Rejenarasyon için Matriks Girişimleri
Hücre yenilenmesi olan progenitör ve neonatal kardiyomiyositlerde baskın olan esnek yapıda elastin içeren ESM bulunması, Zebra balığında ESM de fibronektin birikimi fazlaca olması ve amfibik canlılarda fibronektin, hyaluronan ve matriküloselüler protein tenasin-C nin ESM de baskın olması ve bunların kardiyak rejenerasyon yapabilen canlılar olması, memelilerde deneysel miyokart zedelenmesi yapıldıktan sonra progenatör hücre içeren matriks temelli yamalardan fayda görülmesi ,memeli enfarktüs modellerinde , özgül kardiyomiyositlerin çoğalmasını teşvik edebilecek bazı matrisli makromoleküllerin rejeneratif etkilerinin görülmesi (örneğin büyük ekstraselüler heparan sulfat proteoglikan olan agrin neonatal ve yetişkin farede hücre döngüsünü artırır) bizlere kalp dokusunun rejenere olabileceği konusunda ümit vermektedir.